Hidrostatica e Hidrodinamica

Conceptos fundamentales de Fluidos
La estática de fluidos estudia el equilibrio de gases y líquidos. A partir de los conceptos de densidad y de presión se obtiene la ecuación fundamental de la hidrostática, de la cual el principio de Pascal y el de Arquímedes pueden considerarse consecuencias. El hecho de que los gases, a diferencia de los líquidos, puedan comprimirse hace que el estudio de ambos tipos de fluidos tengan algunas características diferentes. En la atmósfera se dan los fenómenos de presión y de empuje que pueden ser estudiados de acuerdo con los principios de la estática de gases.
Se entiende por fluido un estado de la materia en el que la forma de los cuerpos no es constante, sino que se adapta a la del recipiente que los contiene. La materia fluida puede ser trasvasada de un recipiente a otro, es decir, tiene la capacidad de fluir. Los líquidos y los gases corresponden a dos tipos diferentes de fluidos. Los primeros tienen un volumen constante que no puede mortificarse apreciablemente por compresión. Se dice por ello que son fluidos incompresibles. Los segundos no tienen un volumen propio, sino que ocupan el del recipiente que los contiene; son fluidos compresibles porque, a diferencia de los líquidos, sí pueden ser comprimidos.
El estudio de los fluidos en equilibrio constituye el objeto de la estática de fluidos, una parte de la física que comprende la hidrostática o estudio de los líquidos en equilibrio, y la aerostática o estudio de los gases en equilibrio y en particular del aire.
1. Fuerza y Masa
La comprensión de las propiedades de los fluidos requiere una cuidadosa diferenciación entre "masa y peso", por lo que se aplican las siguientes definiciones:
MASA es la propiedad de un cuerpo de fluido que se mide por su inercia o resistencia a un cambio de movimiento, también es una medida de la cantidad de fluido. Se utiliza el símbolo "m" para la masa.
PESO es la cantidad que pesa un cuerpo, es decir, la fuerza con que el cuerpo es atraído hacia la tierra por la acción de la gravedad. Se utiliza el símbolo "w" para peso.
El peso está relacionado con la masa y la aceleración debida a la gravedad, "g", por la ley de gravitación de Newton (Página 105-143 Serwey).
w = mg ecc.1
Aquí se utilizará G = 9,81 m/s2 (aceleración gravitacional) en el sistema SI y G = 32,2 pies/s2 en el sistema británico de unidades.
2. La densidad de los cuerpos
Los cuerpos difieren por lo general en su masa y en su volumen. Estos dos atributos físicos varían de un cuerpo a otro, de modo que si consideramos cuerpos de la misma naturaleza, cuanto mayor es el volumen, mayor es la masa del cuerpo considerado. No obstante, existe algo característico del tipo de materia que compone al cuerpo en cuestión y que explica el porqué dos cuerpos de sustancias diferentes que ocupan el mismo volumen no tienen la misma masa o viceversa.
Aun cuando para cualquier sustancia la masa y el volumen son directamente proporcionales, la relación de proporcionalidad es diferente para cada sustancia. Es precisamente la constante de proporcionalidad de esa relación la que se conoce por densidad y se representa por la letra griega "r ".
r = m/v ecc. 2
"V" es el volumen de la sustancia cuya masa es M. Las unidades son kilogramos por metros cúbicos en el sistema internacional (SI).
CUADRO 1. Densidad de sólidos y líquidos a (20ºC)
Sustancia | Densidad (g/cm3) | Sustancia | Densidad (g/cm3) |
Acero | 7,7-7,9 | Oro | 19,31 |
Aluminio | 2,7 | Plata | 10,5 |
Cinc | 7,15 | Platino | 31,46 |
Cobre | 8,93 | Plomo | 11,35 |
Cromo | 7,15 | Silicio | 2,3 |
Estaño | 7,29 | Sodio | 0,975 |
Hierro | 7,88 | Titanio | 4,5 |
Magnesio | 1,76 | Vanadio | 6,02 |
Níquel | 8,9 | Volframio | 19,34 |
La DENSIDAD (r ) de una sustancia es la masa que corresponde a un volumen unidad de dicha sustancia. Su unidad en el SI es el cociente entre la unidad de masa y la del volumen, es decir kg/m3; g/cm3, etc.
A diferencia de la masa o el volumen, que dependen de cada objeto, su cociente depende solamente del tipo de material de que está constituido y no de la forma ni del tamaño de aquél. Se dice por ello que la densidad es una propiedad o atributo característico de cada sustancia. En los sólidos la densidad es aproximadamente constante, pero en los líquidos, y particularmente en los gases, varía con las condiciones de medida. Así en el caso de los líquidos se suele especificar la temperatura a la que se refiere el valor dado para la densidad y en el caso de los gases se ha de indicar, junto con dicho valor, la presión.
La densidad está relacionada con el grado de acumulación de materia (un cuerpo compacto es, por lo general, más denso que otro más disperso), pero también lo está con el peso. Así, un cuerpo pequeño que es mucho más pesado que otro más grande es también mucho más denso. Esto es debido a la relación w = m · g existente entre masa y peso.
No obstante, para referirse al peso por unidad de volumen la física ha introducido el concepto de PESO ESPECÍFICO que se define como la cantidad de peso por unidad de volumen de una sustancia. Utilizando la letra griega "g " (gamma) para denotar peso específico, se tiene
g = w/v ecc. 3
"V" es el volumen de una sustancia que tiene el peso "W". Las unidades del peso específico son lo newton por metro cúbico (Nm3) en el SI y libras por pie cúbico (lb/pie3) en el sistema británico de unidades.
A menudo resulta conveniente indicar el peso específico o densidad de un fluido en términos de su relación con el peso específico o densidad de un fluido común. Cuando se utiliza el término "gravedad específica", el fluido de referencia es el agua pura a 4ºC. A tal temperatura, el agua posee su densidad más grande. Entonces, la GRAVEDAD ESPECÍFICA (sg) se puede definir de dos maneras:
a) la gravedad específica es el cociente de la densidad de una sustancia ente la densidad del agua a 4º C.
b) la gravedad específica es el cociente del peso específico de una sustancia ente el peso específico del agua a 4º C.
Estas definiciones de la gravedad específica se pueden expresar de manera matemática como:
Para ver la fórmula seleccione la opción "Descargar" del menú superior
En donde el subíndice "s" se refiere a la sustancia cuya gravedad específica se está determinado y el subíndice "w" se refiere al agua. Las propiedades del agua a 4ºC son constantes, y tienen los valores que se muestran a continuación:
g w @ 4º C = 9,81 kN/m3 ó 62,4 lb/pies3
r w @ 4º C = 1000 kg/m3 ó 1,94 slug/pies3
Relación entre densidad y peso específico
Muy a menudo se debe encontrar el peso específico de una sustancia cuando se conoce su densidad y viceversa, la conversión de una a otra se puede efectuar mediante la siguiente ecuación,
g = r g ecc. 5
,"g" es la aceleración debida a la gravedad.
4. El fundamento del densímetro
La determinación de densidades de líquidos tiene importancia no sólo en la física, sino también en el mundo de la agricultura y de la industria. Por el hecho de ser la densidad una propiedad característica (cada sustancia tiene una densidad diferente) su valor puede emplearse para efectuar una primera comprobación del grado de pureza de una sustancia líquida.
El densímetro es un sencillo aparato que se basa en el principio de Arquímedes (página 427 –431, Serway). Es, en esencia, un flotador de vidrio con un lastre de mercurio en su parte inferior (que le hace sumergirse parcialmente en el líquido) y un extremo graduado directamente en unidades en densidad. El nivel del líquido marca sobre la escala el valor de su densidad.
En el equilibrio, el peso "w" del densímetro será igual al empuje "E", como se verá más adelante:
w = E ecc. 6
Cuando se ejerce una fuerza sobre un cuerpo deformable, los efectos que provoca dependen no sólo de su intensidad, sino también de cómo esté repartida sobre la superficie del cuerpo. Así, un golpe de martillo sobre un clavo bien afilado hace que penetre mas en la pared de lo que lo haría otro clavo sin punta que recibiera el mismo impacto. Un individuo situado de puntillas sobre una capa de nieve blanda se hunde, en tanto que otro de igual peso que calce raquetas, al repartir la fuerza sobre una mayor superficie, puede caminar sin dificultad.
El cociente entre la intensidad "F" de la fuerza aplicada perpendicularmente sobre una superficie dada y el área "A" de dicha superficie se denomina presión.
P = F/A ecc.7
La presión representa la intensidad de la fuerza que se ejerce sobre cada unidad de área de la superficie considerada. Cuanto mayor sea la fuerza que actúa sobre una superficie dada, mayor será la presión, y cuanto menor sea la superficie para una fuerza dada, mayor será entonces la presión resultante.
La presión en los fluidos
El concepto de presión es muy general y por ello puede emplearse siempre que exista una fuerza actuando sobre una superficie. Sin embargo, su empleo resulta especialmente útil cuando el cuerpo o sistema sobre el que se ejercen las fuerzas es deformable. Los fluidos no tienen forma propia y constituyen el principal ejemplo de aquellos casos en los que es más adecuado utilizar el concepto de presión que el de fuerza.
Cuando un fluido está contenido en un recipiente, ejerce una fuerza sobre sus paredes y, por tanto, puede hablarse también de presión. Si el fluido está en equilibrio las fuerzas sobre las paredes son perpendiculares a cada porción de superficie del recipiente, ya que de no serlo existirían componentes paralelas que provocarían el desplazamiento de la masa de fluido en contra de la hipótesis de equilibrio. La orientación de la superficie determina la dirección de la fuerza de presión, por lo que el cociente de ambas, que es precisamente la presión, resulta independiente de la dirección; se trata entonces de una magnitud escalar.
Unidades de presión
En el Sistema Internacional (SI) la unidad de presión es el pascal, se representa por Pa y se define como la presión correspondiente a una fuerza de un newton de intensidad actuando perpendicularmente sobre una superficie plana de un metro cuadrado. 1 Pa equivale, por tanto, a 1 N/m2.
Existen, no obstante, otras unidades de presión que sin corresponder a ningún sistema de unidades en particular han sido consagradas por el uso y se siguen usando en la actualidad junto con el pascal. Entre ellas se encuentran la atmósfera y el bar.
La atmósfera (atm) se define como la presión que a 0 ºC ejercería el peso de una columna de mercurio de 76 cm de altura y 1 cm2 de sección sobre su base.
Es posible calcular su equivalencia en N/m2 sabiendo que la densidad del mercurio es igual a 13,6x103 kg/m3 y recurriendo a las siguientes relaciones entre magnitudes:
w (N) = masa (kg) · 9,8 m/s2
Masa = volumen · densidad
es decir: 1 atm = 1,013x105 Pa.
El bar es realmente un múltiple del pascal y equivale a 105 N/m2. En meteorología se emplea con frecuencia el milibar (mb) o milésima parte del bar 1 mb = 102 Pa ó 1 atm = 1013 mb.
UNIDAD II
Hidrostática
1. Variación de la presión con la profundidad
Todos los líquidos pesan, por ello cuando están contenidos en un recipiente las capas superiores oprimen a las inferiores, generándose una presión debida al peso. La presión en un punto determinado del líquido deberá depender entonces de la altura de la columna de líquido que tenga por encima suyo.
Considérese un líquido de densidad r en reposo y abierto a la atmósfera. Seleccionaremos una muestra de líquido contenida por un cilindro imaginario de área de sección transversal A que se extiende desde la superficie del líquido hasta una profundidad "h". La presión ejercida por el fluido sobre la cara inferior es P, y la presión sobre la cara superior del cilindro es la presión atmosférica, Po. Por consiguiente, la fuerza hacia arriba ejercida por el líquido sobre el fondo del cilindro es Pa, y la fuerza hacia abajo ejercida por la atmósfera sobre la parte superior es PoA. Debido a que la masa del líquido en el cilindro es r V = r Ah, el peso del fluido en el cilindro es w = r gv = r gAh. Como el cilindro está en equilibrio, la fuerza hacia abajo en la parte superior de la muestra para soportar su peso es igual a
Pa = Po + r gh ecc.7
(llamada ecuación fundamental de la hidrostática) ,donde la presión atm es 1,01 x 105 Pascales. En otras palabras la presión absoluta "Pa" una profundidad "h" debajo de la superficie de un líquido abierto a la atmósfera es mayor que la presión atmosférica en una cantidad r gh. Ello implica que ni la forma de un recipiente ni la cantidad de líquido que contiene influyen en la presión que se ejerce sobre su fondo, tan sólo la altura de líquido.
En vista del hecho de que la presión en un líquido sólo depende de la profundidad, cualquier incremento de presión en la superficie debe transmitirse a cada punto en el fluido. Esto lo reconoció por primera vez el científico Alemán Blaise Pascal (1923-1662) y se conoce como ley de Pascal (Página 18-22 Maiztegui-Sabato).
Aplicación:
Un submarinista se sumerge en el mar hasta alcanzar una profundidad de 100 m. Determinar la presión a la que está sometido y calcular en cuántas veces supera a la que experimentaría en el exterior, sabiendo que la densidad del agua del mar es de 1025 kg/m3.
Solución:
De acuerdo con la ecuación fundamental de la hidrostática:
Considerando que la presión Po en el exterior es de una atmósfera (1 atm = 1,013 x 105 Pa), al sustituir los datos en la anterior ecuación resulta:
P = 1,013x105 Pa+ 1025 kg/m3 x 9,8 m/s2 · 100 m = 11,058x105 Pa
El número de veces que P es superior a la presión exterior Po se obtiene hallando el cociente entre ambas lo que indica que es 10,9 veces superior la presión Pa.
2. El principio de Pascal y sus aplicaciones
La presión aplicada en un punto de un líquido contenido en un recipiente se transmite con el mismo valor a cada una de las partes del mismo.
Este enunciado, obtenido a partir de observaciones y experimentos por el físico y matemático B. Pascal, se conoce como principio de Pascal.
El principio de Pascal puede ser interpretado como una consecuencia de la ecuación fundamental de la hidrostática y del carácter incompresible de los líquidos. En esta clase de fluidos la densidad es constante, de modo que de acuerdo con la ecuación P = Po + r gh si se aumenta la presión en la superficie libre, por ejemplo, la presión en el fondo ha de aumentar en la misma medida, ya que r g no varía al no hacerlo h.
La prensa hidráulica constituye la aplicación fundamental del principio de Pascal y también un dispositivo que permite entender mejor su significado. Consiste, en esencia, en dos cilindros de diferente sección comunicados entre sí, y cuyo interior está completamente lleno de un líquido que puede ser agua o aceite. Dos émbolos de secciones diferentes se ajustan, respectivamente, en cada uno de los dos cilindros, de modo que estén en contacto con el líquido. Cuando sobre el émbolo de menor sección A1 se ejerce una fuerza F1 la presión P1 que se origina en el líquido en contacto con él se transmite íntegramente y de forma instantánea a todo el resto del líquido; por tanto, será igual a la presión P2 que ejerce el líquido sobre el émbolo de mayor sección A2, es decir:
P1 = P2
Si la sección A2 es veinte veces mayor que la A1, la fuerza F1 aplicada sobre el émbolo pequeño se ve multiplicada por veinte en el émbolo grande.
La prensa hidráulica es una máquina simple semejante a la palanca de Arquímedes, que permite amplificar la intensidad de las fuerzas y constituye el fundamento de elevadores, prensas, frenos y muchos otros dispositivos hidráulicos de maquinaria industrial.
Ejemplo programado:
Con referencia a la figura 1 (prensa hidráulica), las áreas del pistón A y del cilindro B, son respectivamente de 40 y 4000 cm2 y B pesa 4000 Kg. Los depósitos y las conducciones con conexión están llenas de aceite con una densidad de 750 kg/cm3 ¿Cuál es la Fuerza en A (en la Presión a) necesaria para mantener el equilibrio si se desprecia el peso de A?
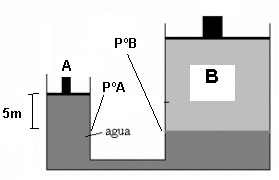
Figura 1. Ejercicio Prensa Hidráulica
Solución:
Pa + 750 kg/m3 x 5 m = 4000 Kg/4000 cm2
Pa + 3750Kg/100*100 cm2 = 1 Kg/cm2
Pa = 0,625 Kg/cm2
Presión = F x área (40cm2)= F = 25 Kg es la fuerza en A (en la Presión a) necesaria para mantener el equilibrio el sistema.
3. El principio de los vasos comunicantes
Si se tienen dos recipientes comunicados y se vierte un líquido en uno de ellos en éste se distribuirá entre ambos de tal modo que, independientemente de sus capacidades, el nivel de líquido en uno y otro recipiente sea el mismo. Éste es el llamado principio de los vasos comunicantes, que es una consecuencia de la ecuación fundamental de la hidrostática.
Si se toman dos puntos A y B situados en el mismo nivel, sus presiones hidrostáticas han de ser las mismas, es decir:
luego si Pa = Pb necesariamente las alturas ha y hb de las respectivas superficies libres han de ser idénticas ha = hb.
Si se emplean dos líquidos de diferentes densidades y no miscibles, entonces las alturas serán inversamente proporcionales a las respectivas densidades. En efecto, se tiene:
Pa + r gh = Pb + r gh ecc.8
Esta ecuación permite, a partir de la medida de las alturas, la determinación experimental de la densidad relativa de un líquido respecto de otro y constituye, por tanto, un modo de medir densidades de líquidos no miscibles si la de uno de ellos es conocida.
4. Empuje hidrostático: principio de Arquímedes
Los cuerpos sólidos sumergidos en un líquido experimentan un empuje hacia arriba. Este fenómeno, que es el fundamento de la flotación de los barcos, era conocido desde la más remota antigüedad, pero fue el griego Arquímedes (287-212 a. de C.) quien indicó cuál es la magnitud de dicho empuje. De acuerdo con el principio que lleva su nombre, todo cuerpo sumergido total o parcialmente en un líquido experimenta un empuje vertical y hacia arriba igual al peso del volumen de líquido desalojado.
El principio de Arquímedes puede comprobarse de la siguiente manea. Supóngase que centramos nuestra atención en el cubo de fluido dentro del recipiente de la figura ( ). Este cubo de fluido está en equilibrio bajo la acción de las fuerzas que actúan sobre él. Una de ellas es su peso. ¿Qué cancela la fuerza hacia abajo? Aparentemente, el resto del fluido dentro del recipiente se mantiene en equilibrio. Así, la fuerza de flotación "B" sobre el cubo de fluido es exactamente igual en magnitud al peso del fluido dentro del cubo:
E = w ecc. 6
Ahora mostraremos explícitamente que la fuerza de flotación es igual en magnitud al peso del fluido desplazado. La presión en el fondo del cubo en la figura 2 es más grande que la presión en la parte superior por una cantidad r fgh, donde r f es la densidad del fluido y h es la altura del cubo. Puesto que la diferencia de presión, D P, es igual a la fuerza de flotación por unidad de área, es decir, D P =E/A, vemos que E = (D P)A = (r fgh)A = r fgV, donde V es el volumen del cubo. Puesto que la masa del fluido en el cubo es m = r fV, vemos que
E = W = r f ecc.9
donde W es el peso del fluido desplazado.

<> Figura 2. W = E
Caso I. Un objeto sumergido totalmente. Cuando un objeto está totalmente sumergido en un fluido de densidad r f la fuerza de flotación hacia arriba está dada por E = r fVog; donde Vo es el volumen del objeto. Si el objeto tiene una densidad r o, su peso es igual a w = mg = r o Vog y la fuerza neta sobre él es E-w = (r f -r o)Vog. Por lo tanto, si la densidad del objeto es menor que la densidad del fluido, como la figura 3a, el objeto es mayor que la densidad del fluido, como la figura 3b, el objeto se hundirá.

<>

a) Un objeto totalmente sumergido que es menos denso que el fluido en el que está inmerso experimentará una fuerza neta hacia arriba
<> b) Un objeto sumergido totalmente que es más denso que el fluido se hunde.
Figura 3a y 3b. Objeto sumergido totalmente
Caso II. Un Objeto en flotación. Consideremos un objeto en equilibrio estático que flota en un fluido, es decir, un objeto parcialmente sumergido. En este caso, la fuerza de flotación hacia arriba se equilibra con el peso hacia abajo del objeto. Si V es el volumen del fluido desplazado por el objeto (el cual corresponde al volumen del objeto del nivel del fluido), entonces la fuerza de flotación tiene una magnitud E = r fVg. Puesto que el peso del objeto es W = mg = r o Vog y w = E, vemos que r fVg = r o Vog ó
r o/r f = V/Vo<> ecc.10
Ejemplo programado:
En un vaso de vidrio lleno de agua, flota un cubo de hielo. ¿Qué fracción del cubo sobresale del nivel de agua?.
Solución:
Este problema corresponde al caso II descrito anteriormente. El peso del cubo de hielo es W = r iVig, donde r i = 917 Kg/m3 y Vi = es el volumen del cubo de hielo. La fuerza de flotación hacia arriba es igual al peso del agua desplazada; es decir, E = r wVg, donde V es el volumen del cubo de hielo debajo del agua y r w es la densidad del agua, que es 1000 Kg/m3.
Como r iVig = r wVg, la fracción de hielo debajo del agua es V/Vi = r i/r w. Por consiguiente, la fracción de hielo sobre el nivel de agua es:
V/Vi = 917 (Kg/m3) /1000 (Kg/m3) = 0,917
V/Vi = 0,917
Por lo que el cubo de hielo tiene un 91,7% sumergido y un 8,3% sobre el nivel del agua.
5. Presión manométrica y absoluta
Cuando se realizan cálculos que implican la presión de un fluido, se debe hacer la medición en relación con alguna presión de referencia. Normalmente, la presión de referencia es la atmosférica, y la presión resultante que se mide se conoce como PRESIÓN MANOMÉTRICA. La presión que se mide con relación con el vacío perfecto se conoce con el nombre de PRESIÓN ABSOLUTA.
P absoluta = P manométrica + P atmosférica ecc.11
Ejemplo programado::
Exprese una presión de 155 Kpa como una presión absoluta. La presión atmosférica local es de 98 Kpa.
Solución:
P abs = P Mno + P atm
P abs = 155 Kpa + 98 Kpa = 253 Kpa
Un manómetro es un aparato que sirve para medir la presión de los fluidos contenidos en recipientes cerrados. Existen, básicamente, dos tipos de manómetros: los de líquidos y los metálicos.
Los manómetros de líquidos emplean, por lo general, mercurio que llena un tubo en forma de J. El tubo puede estar o abierto por ambas ramas o abierto por una sola. En ambos casos la presión se mide conectando al recipiente que contiene el gas el tubo por su rama inferior y abierta y determinando el desnivel h de la columna de mercurio entre ambas ramas. Si el manómetro es de tubo abierto entonces es necesario tomar en cuenta la presión atmosférica Po en la ecuación P = Po + r gh. Si es de tubo cerrado, la presión vendrá dada directamente por P = r gh. Los manómetros de este segundo tipo permiten, por sus características, la medida de presiones elevadas.
En los manómetros metálicos la presión del gas da lugar a deformaciones en una cavidad o tubo metálico. Estas deformaciones se transmiten a través de un sistema mecánico a una aguja que marca directamente la presión del gas sobre una escala graduada.
CAPITULO III
El fluido como un continuo
Un fluido es una sustancia que se deforma continuamente al ser sometida a un esfuerzo cortante (esfuerzo tangencial) no importa cuan pequeño sea.
Todos los fluidos están compuestos de moléculas que se encuentran en movimiento constante. Sin embargo, en la mayor parte de las aplicaciones de ingeniería, nos interesa más conocer el efecto global o promedio (es decir, macroscópico) de las numerosas moléculas que forman el fluido. Son estos efectos macroscópicos los que realmente podemos percibir y medir.
Por lo anterior, consideraremos que el fluido está idealmente compuesto de una sustancia infinitamente divisible (es decir, como un continuo) y no nos preocuparemos por el comportamiento de las moléculas individuales.
El concepto de un continuo es la base de la mecánica de fluidos clásica. La hipótesis de un continuo resulta válida para estudiar el comportamiento de los fluidos en condiciones normales. Sin embargo, dicha hipótesis deja de ser válida cuando la trayectoria media libre de las moléculas (aproximadamente 6,3 x 10-5 mm o bien 2.5 x 10-6 pulg para aire en condiciones normales de presión y temperatura) resulta del mismo orden de magnitud que la longitud significativa más pequeña, característica del problema en cuestión.
Una de las consecuencias de la hipótesis del continuo es que cada una de las propiedades de un fluido se supone que tenga un valor definido en cada punto del espacio. De esta manera, propiedades como la densidad, temperatura, velocidad, etc., pueden considerarse como funciones continuas de la posición y del tiempo.
-
Hemos definido un fluido como una sustancia que se deforma continuamente bajo la acción de un esfuerzo cortante. En ausencia de éste, no existe deformación. Los fluidos se pueden clasificar en forma general, según la relación que existe entre el esfuerzo cortante aplicado y la rapidez de deformación resultante . Aquellos fluidos donde el esfuerzo cortante es directamente proporcional a la rapidez de deformación se denominan fluidos newtonianos. La mayor parte de los fluidos comunes como el agua, el aire, y la gasolina son prácticamente newtonianos bajo condiciones normales. El término no newtoniano se utiliza para clasificar todos los fluidos donde el esfuerzo cortante no es directamente proporcional a la rapidez de deformación.
Numerosos fluidos comunes tienen un comportamiento no newtoniano. Dos ejemplos muy claros son la crema dental y la pintura Lucite. Esta última es muy "espesa" cuando se encuentra en su recipiente, pero se "adelgaza" si se extiende con una brocha. De este modo, se toma una gran cantidad de pintura para no repetir la operación muchas veces. La crema dental se comporta como un "fluido" cuando se presiona el tubo contenedor. Sin embargo, no fluye por sí misma cuando se deja abierto el recipiente. Existe un esfuerzo limite, de cedencia, por debajo del cual la crema dental se comporta como un sólido. En rigor, nuestra definición de fluido es válida únicamente para aquellos materiales que tienen un valor cero para este esfuerzo de cedencia. En este texto no se estudiarán los fluidos no newtonianos.
- Fluidos Newtonianos y No Newtonianos
- Viscosidad
Si se considera la deformación de dos fluidos newtonianos diferentes, por ejemplo, glicerina y agua, se encontrará que se deforman con diferente rapidez para una misma fuerza cortante. La glicerina ofrece mucha mayor resistencia a la deformación que el agua; se dice entonces que es mucho más viscosa.
La VISCOSIDAD DINÁMICA (u), se presenta cuando un fluido se mueve y se desarrolla en el una tensión de corte, denotada con la letra griega " t" (tao), y puede definirse como la fuerza requerida para deslizar una capa de área unitaria de una sustancia sobre otra capa de la misma sustancia. En un fluido común, como el agua, el aceite o alcohol encontramos que la magnitud de corte es directamente proporcional al cambio de velocidad entre diferentes posiciones del fluido. En el cuadro 2 se presentan valores de viscosidad dinámica para distintos fluidos.
CUADRO 2. Valores de viscosidad dinámica para algunos fluidos
Fluido | Temperatura (ºC) | V. Dinámica u (Ns/m2) |
Agua | 20 | 1 x 10-3 |
Gasolina | 20 | 3,1 x 10-4 |
Aceite SAE 30 | 30 | 3,5 x 10-1 |
Aceite SAE 30 | 80 | 1,9 x 10-2 |
En la mecánica de fluidos se emplea muy frecuentemente la VISCOSIDAD CINEMÁTICA
v = u/r ecc.12
donde u viscosidad dinámica y las dimensiones en el SI que resultan para v son [m2/s].
La viscosidad es una manifestación del movimiento molecular dentro del fluido. Las moléculas de regiones con alta velocidad global chocan con las moléculas que se mueven con una velocidad global menor, y viceversa. Estos choques permiten transportar cantidad de movimiento de una región de fluido a otra. Ya que los movimientos moleculares aleatorios se ven afectados por la temperatura del medio, la viscosidad resulta ser una función de la temperatura
Descripción y clasificación de los movimientos de un fluido
Antes de proceder con un análisis, intentaremos una clasificación general de la mecánica de fluidos sobre la base de las características físicas observables de los campos de flujo. Dado que existen bastantes coincidencias entre unos y otros tipos de flujos, no existe una clasificación universalmente aceptada. Una posibilidad es la que se muestra en la figura 4.
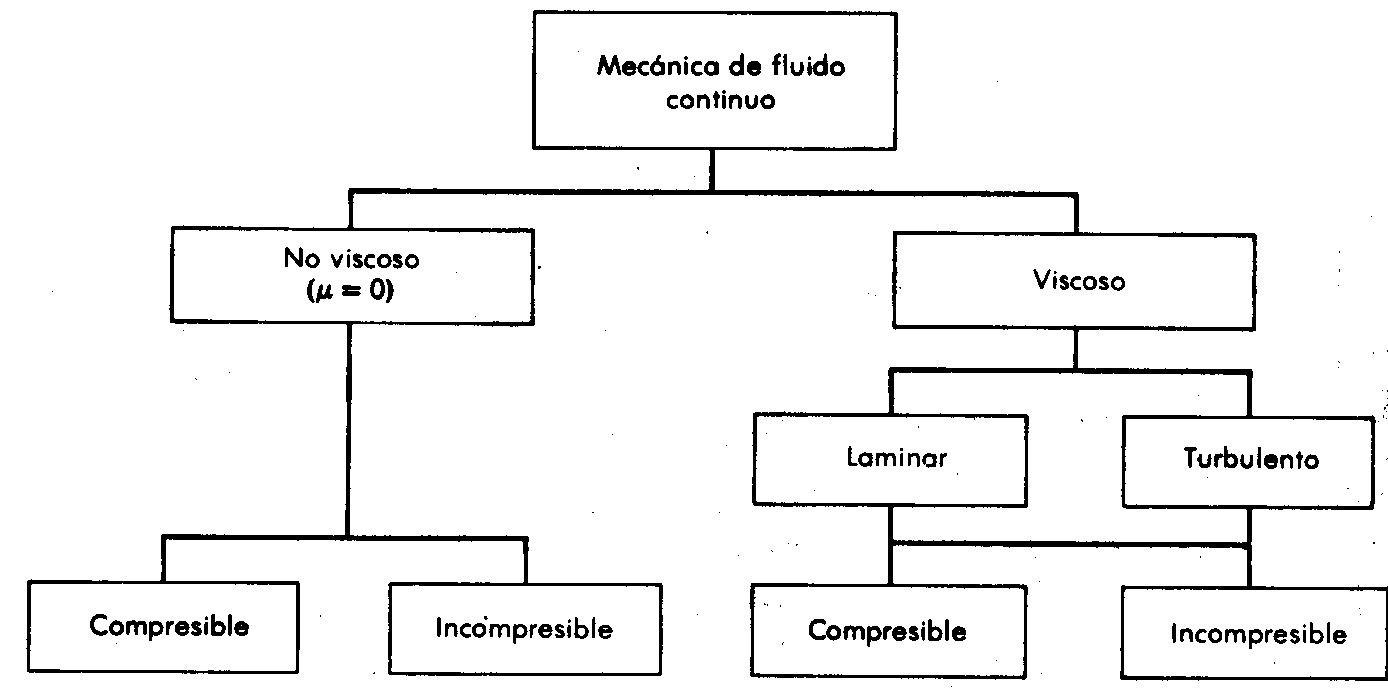
Figura 4. Esquema general de Fluidos continuos
3.1. Flujos Viscosos y no Viscosos
La subdivisión principal señalada en la figura anterior se tiene entre los flujos viscosos y no viscosos. En un flujo no viscoso se supone que la viscosidad de fluido u, vale cero. Evidentemente, tales flujos no existen; sin embargo; se tienen numerosos problemas donde esta hipótesis puede simplificar el análisis y al mismo tiempo ofrecer resultados significativos. (Si bien, los análisis simplificados siempre son deseables, los resultados deben ser razonablemente exactos para que tengan algún valor.) Dentro de la subdivisión de flujo viscoso podemos considerar problemas de dos clases principales. Flujos llamados incompresibles, en los cuales las variaciones de densidad son pequeñas y relativamente poco importantes. Flujos conocidos como compresibles donde las variaciones de densidad juegan un papel dominante como es el caso de los gases a velocidades muy altas.
Por otra parte, todos los fluidos poseen viscosidad, por lo que los flujos viscosos resultan de la mayor importancia en el estudio de mecánica de fluidos.
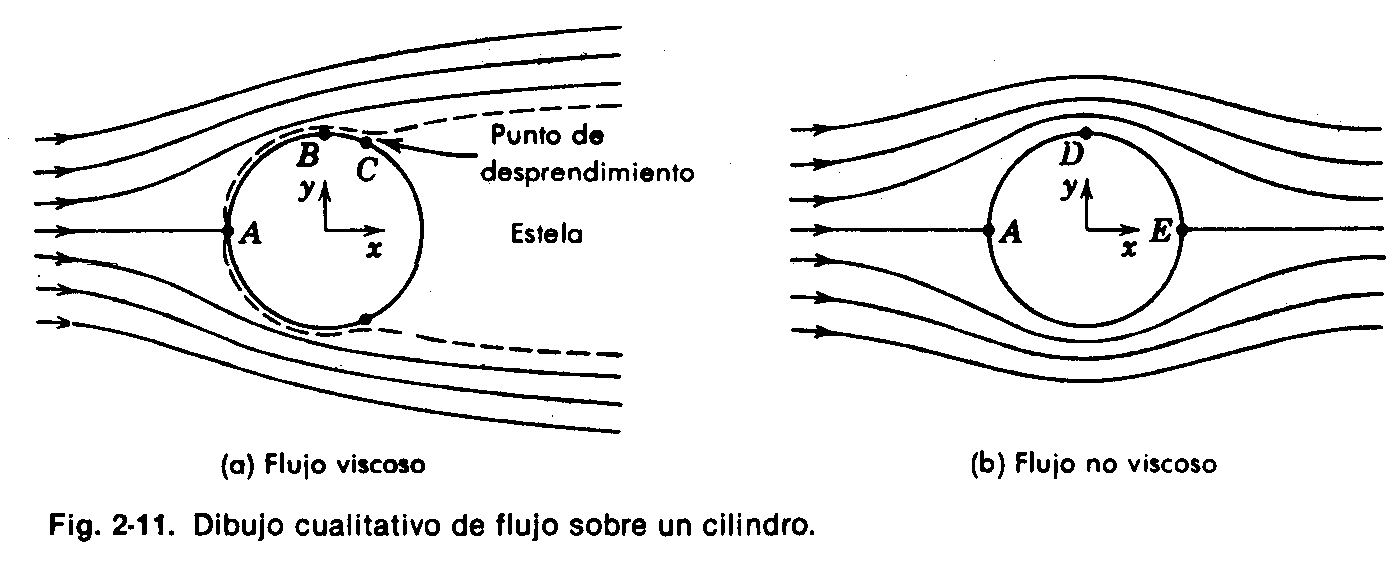
Figura 4. Dibujo cualitativo de flujo sobre un cilindro
Podemos observar que las líneas de corriente son simétricas respecto al eje x. El fluido a lo largo de la línea de corriente central se divide y fluye alrededor del cilindro una vez que ha incidido en el punto A. Este punto sobre el cilindro recibe el nombre de punto de estancamiento. Al igual que en el flujo sobre una placa plana, se desarrolla una capa límite en las cercanías de la pared sólida del cilindro. La distribución de velocidades fuera de la capa límite se puede determinar teniendo en cuenta el espaciamiento entre líneas de corriente. Puesto que no puede haber flujo a través de una línea de corriente, es de esperarse que la velocidad del fluido se incremente en aquellas regiones donde el espaciamiento entre líneas de corrientes disminuya. Por el contrario, un incremento en el espaciamiento entre líneas de corriente implica una disminución en la velocidad del fluido.
Considérese momentáneamente el flujo incompresible alrededor del cilindro, suponiendo que se trate de un flujo no viscoso, como el mostrado en la figura 4b, este flujo resulta simétrico respecto tanto al eje x como al eje y. La velocidad alrededor del cilindro crece hasta un valor máximo en el punto D y después disminuye conforme nos movemos alrededor del cilindro. Para un flujo no viscoso, un incremento en la velocidad siempre va acompañado de una disminución en la presión, y viceversa. De esta manera, en el caso que nos ocupa, la presión sobre la superficie del cilindro disminuye conforme nos movemos del punto A al punto D y después se incrementa al pasar del punto D hasta el E. Puesto que el flujo es simétrico respecto a los dos ejes coordenados, es de esperarse que la distribución de presiones resulte también simétrica respecto a estos ejes. Este es, en efecto, el caso.
No existiendo esfuerzos cortantes en un flujo no viscoso, para determinar la fuerza neta que actúa sobre un cilindro solamente se necesita considerar las fuerzas de presión. La simetría en la distribución de presiones conduce a la conclusión de que en un flujo no viscoso no existe una fuerza neta que actúe sobre un cilindro, ya sea en la dirección x o en la dirección y. La fuerza neta en la dirección x recibe el nombre de arrastre. Según lo anterior, se concluye que el arrastre para un cilindro en un flujo no viscoso es cero; esta conclusión evidentemente contradice nuestra experiencia, ya que sabemos que todos los cuerpos sumergidos en un flujo real experimentan algún arrastre. Al examinar el flujo no viscoso alrededor de un cuerpo hemos despreciado la presencia de la capa límite, en virtud de la definición de un flujo no viscoso. Regresemos ahora a examinar el caso real correspondiente.
Para estudiar el caso real de la figura 4a, supondremos que la capa límite es delgada. Si tal es el caso, es razonable suponer además que el campo de presiones es cualitativamente el mismo que en el correspondiente flujo no viscoso. Puesto que la presión disminuye continuamente entre los puntos A y B un elemento de fluido dentro de la capa límite experimenta una fuerza de presión neta en la dirección del flujo. En la región entre A y B, esta fuerza de presión neta es suficiente para superar la fuerza cortante resistente, manteniéndose el movimiento del elemento en la dirección del flujo.
Considérese ahora un elemento de fluido dentro de la capa límite en la parte posterior del cilindro detrás del punto B. Puesto que la presión crece en la dirección del flujo, dicho elemento de fluido experimenta una fuerza de presión neta opuesta a la dirección del movimiento. En algún punto sobre el cilindro, la cantidad de movimiento del fluido dentro de la capa limite resulta insuficiente para empujar al elemento más allá dentro de la región donde crece la presión. Las capas de fluido adyacentes a la superficie del sólido alcanzarán el reposo, y el flujo se separará de la superficie; el punto preciso donde esto ocurre se llama punto de separación o desprendimiento. La separación de la capa límite da como resultado la formación de una región de presión relativamente baja detrás del cuerpo; esta región resulta deficiente también en cantidad de movimiento y se le conoce como estela. Se tiene, pues, que para el flujo separado alrededor de un cuerpo, existe un desbalance neto de las fuerzas de presión, en la dirección del flujo dando como resultado un arrastre debido a la presión sobre el cuerpo. Cuanto mayor sea el tamaño de la estela detrás del cuerpo, tanto mayor resultará el arrastre debido a la presión.
Es lógico preguntarnos cómo se podría reducir el tamaño de la estela y por lo tanto el arrastre debido a la presión. Como una estela grande surge de la separación de la capa límite, y este efecto a su vez se debe a la presencia de un gradiente de presión adverso (es decir, un incremento de presión en la dirección del flujo), la reducción de este gradiente adverso debe retrasar el fenómeno de la separación y, por tanto, reducir el arrastre.
El fuselado de un cuerpo reduce la magnitud del gradiente de presión adverso al distribuirlo sobre una mayor distancia. Por ejemplo, si se añadiese una sección gradualmente afilada (cuña) en la parte posterior del cilindro de
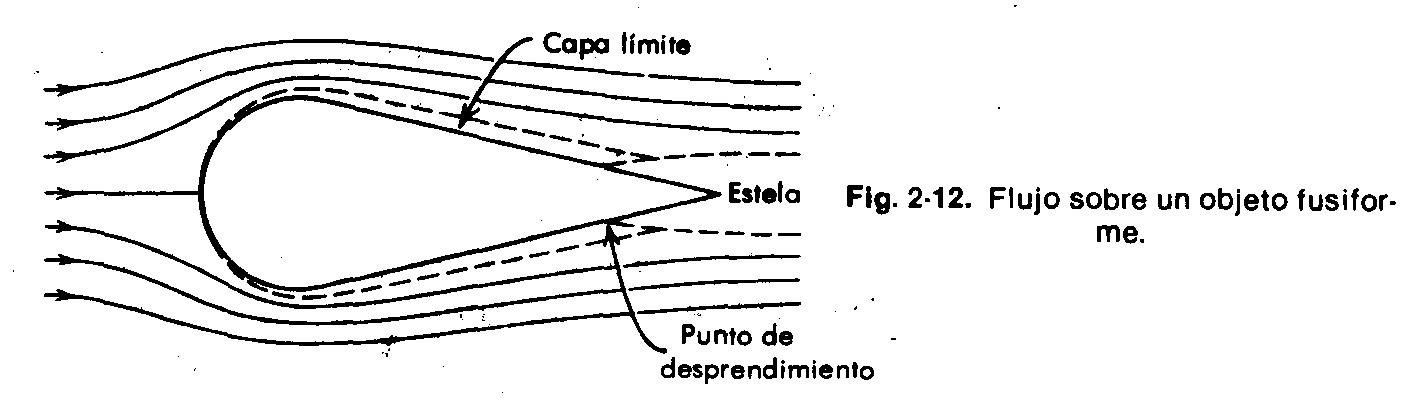
Figura 5. Flujo sobre un objeto fusiforme
la figura 4, el flujo cualitativamente sería como se muestra en la figura 5. El fuselaje en la forma del cuerpo efectivamente retrasa el punto de separación, si bien la superficie del cuerpo expuesta al flujo y, por lo tanto, la fuerza cortante total que actúa sobre el cuerpo, se ven incrementadas, el arrastre total se ve reducido de manera significativa.
La separación del flujo se puede presentar también en flujos internos (es decir, flujos a través de ductos) como resultado de cambios bruscos en la geometría del ducto.
3.2. Flujos laminares y turbulentos
Los flujos viscosos se pueden clasificar en laminares o turbulentos teniendo en cuenta la estructura interna del flujo. En un régimen laminar, la estructura del flujo se caracteriza por el movimiento de láminas o capas. La estructura del flujo en un régimen turbulento por otro lado, se caracteriza por los movimientos tridimensionales, aleatorios, de las partículas de fluido, superpuestos al movimiento promedio.
En un flujo laminar no existe un estado macroscópico de las capas de fluido adyacentes entre sí. Un filamento delgado de tinta que se inyecte en un flujo laminar aparece como una sola línea; no se presenta dispersión de la tinta a través del flujo, excepto una difusión muy lenta debido al movimiento molecular. Por otra parte, un filamento de tinta inyectado en un flujo turbulento rápidamente se dispersa en todo el campo de flujo; la línea del colorante se descompone en una enredada maraña de hilos de tinta. Este comportamiento del flujo turbulento se debe a las pequeñas fluctuaciones de velocidad superpuestas al flujo medio de un flujo turbulento; el mezclado macroscópico de partículas pertenecientes a capas adyacentes de fluido da como resultado una rápida dispersión del colorante. El filamento rectilíneo de humo que sale de un cigarrillo expuesto a un ambiente tranquilo, ofrece una imagen clara del flujo laminar. Conforme el humo continúa subiendo, se transforma en un movimiento aleatorio, irregular; es un ejemplo de flujo turbulento.
El que un flujo sea laminar o turbulento depende de las propiedades del caso. Así, por ejemplo, la naturaleza del flujo (laminar o turbulento) a través de un tubo se puede establecer teniendo en cuenta el valor de un parámetro adimensional, el número de Reynolds,
Re = r VD/u, ecc.13
donde r es la densidad del fluido, V la velocidad promedio, D el diámetro del tubo y u la viscosidad.
El flujo dentro de una capa límite puede ser también laminar o turbulento; las definiciones de flujo laminar y flujo turbulento dadas anteriormente se aplican también en este caso. Las características de un flujo pueden ser significativamente diferentes dependiendo de que la capa límite sea laminar o turbulenta. Los métodos de análisis también son diferentes para un flujo laminar que para un flujo turbulento. Por lo tanto, al iniciar el análisis de un flujo dado es necesario determinar primero si se trata de un flujo laminar o de un flujo turbulento.
3.3. Flujo compresible e incompresible
Aquellos flujos donde las variaciones en densidad son insignificantes se denominan incompresibles; cuando las variaciones en densidad dentro de un flujo no se pueden despreciar, se llaman compresibles. Si se consideran los dos estados de la materia incluidos en la definición de fluido, líquido y gas, se podría caer en el error de generalizar diciendo que todos los flujos líquidos son flujos incompresibles y que todos los flujos de gases son flujos compresibles.
La primera parte de esta generalización es correcta para la mayor parte de los casos prácticos, es decir, casi todos los flujos líquidos son esencialmente incompresibles. Por otra parte, los flujos de gases se pueden también considerar como incompresibles si las velocidades son pequeñas respecto a la velocidad del sonido en el fluido; la razón de la velocidad del flujo, V, a la velocidad del sonido, c, en el medio fluido recibe el nombre de número de Mach, M, es decir,
M=V/c ecc. 14
Los cambios en densidad son solamente del orden del 2% de valor medio, para valores de M < 0,3. Así, los gases que fluyen con M < 0,3 se pueden considerar como incompresibles; un valor de M = 0,3 en el aire bajo condiciones normales corresponde a una velocidad de aproximadamente 100 m/s.
Los flujos compresibles se presentan con frecuencia en las aplicaciones de ingeniería. Entre los ejemplos más comunes se pueden contar los sistemas de aire comprimido utilizados en la operación de herramienta de taller y de equipos dentales, las tuberías de alta presión para transportar gases, y los sistemas censores y de control neumático o fluídico.
4. Ecuación de Continuidad
La ecuación de continuidad o conservación de masa es una herramienta
muy útil para el análisis de fluidos que fluyen a través de tubos o ductos con diámetro variable. En estos casos, la velocidad del flujo cambia debido a que el área transversal varía de una sección del ducto a otra.
Si se considera un fluido con un flujo estable a través de un volumen fijo como un tanque con una entrada y una salida, la razón con la cual el fluido entra en el volumen debe ser igual a la razón con la que el fluido sale del volumen para que se cumpla el principio fundamental de conservación de masa.
Según se muestra la figura 6,
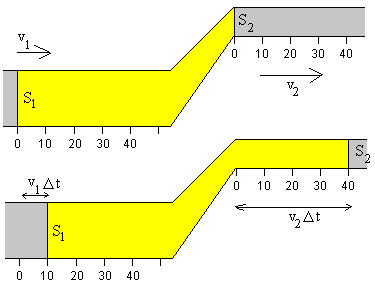
Figura 6. Flujo en tuberías de distinto diámetro
Debido a que el flujo es estacionario entra al dispositivo por un ducto con área transversal A1, y velocidad V1, y sale de este por un segundo ducto, con área transversal A2 a una velocidad V2 . Luego se cumple que
A1V1 = A2 V2 ecc.15
Caudal (Q) es VA, por lo tanto siguiendo los principios de la ley de conservación de carga se tiene
Q = A V ecc.16
donde las unidades son l/s; cm3/min; M3/h, etc.
Esta relación se denomina ecuación de continuidad.
Ejemplo programado:
Una manguera de agua de 2 cm de diámetro es utilizada para llenar una cubeta de 20 litros. Si se tarda 1 minuto para llenar la cubeta, ¿ Cuál es la velocidad V a la cual el agua sale de la manguera?
5. Teorema de Benoulli
<> Daniel Bernoulli fue un físico y matemático Suizo que hizo importantes descubrimientos en hidrodinámica. El trabajo más importante trata de un estudio tanto teórico como práctico del equilibrio, la presión y la velocidad de los fluidos. Demostró que conforme aumenta la velocidad del flujo del fluido, disminuye su presión, conocido como el "principio de Bernoulli".
P1A1, donde P1 es la presión en la sección 1 (Figura 7). El trabajo realizado por esta fuerza es W1 = F1D x1 = P1A1D x1 = P1D V, donde D V es el volumen de la sección 1. De manera similar, el trabajo realizado sobre el fluido en el extremo superior en el tiempo D t es W2 = -P2A2D x2 = P2D V. (El volumen que pasa por la sección 1 en un tiempo D t es igual al volumen que pasa por la sección 2 en el mismo intervalo de tiempo). Este trabajo es negativo porque la fuerza del fluido se opone al desplazamiento. Así vemos que el trabajo neto hecho por esas fuerzas en el tiempo D t es
W = (P1 – P2) D V
Parte de este trabajo se utiliza para cambiar la energía cinética del fluido y otra para cambiar la energía potencial gravitacional. Si D m es la masa que pasa por el tubo en el tiempo D t, entonces el cambio en su energía cinética es
D<> K = ½ (D m)V22 – ½ (D m)V12
El cambio en la energía potencial gravitacional es
D U = D mgy2 - D mgy1
Podemos aplicar el teorema del trabajo y la energía en la forma W = D K + D U a este volumen de fluido y obtener
(P1 – P2) D V = ½ (D m)V22 – ½ (D m)V12 + D mgy2 - D mgy1
Si dividimos cada término entre D V y recordamos que r = D m/D V, la expresión anterior se reduce a
P1 – P2 = ½ r V22 - ½ r V12 + r gy2 - r gy1
Al recordar los términos, obtenemos
P1 + ½ r V12 + r gy1 = P2 + ½ r V22 + r gy2<> ecc. 17
P + ½ r V2 + r gy = Constante ecc.18
La ecuación de Bernoulli señala que la suma de presión, (P), la enería cinética por unidad de volumen (½ r V2) y la energía potecial gravitacional por unidad de volumen r gy tiene el mismo valor en todos los puntos a lo largo de la corriente.
Para ver el gráfico seleccione la opción "Descargar" del menú superior
Figura 7. Un Fluido de circulación en tubo cuyo diámetro se reduce con flujo de línea corriente.
Ejemplo programado:
Un depósito de agua está cerrado por encima con una placa deslizante de 12 m2 y 1200 kg de masa. El nivel del agua en el depósito es de 3,5 m de altura. Calcular la presión en el fondo. Si se abre un orificio circular de 5 cm de radio a medio metro por encima del fondo, calcúlese el volumen de agua que sale por segundo por este orificio. (Se considera que el área del orificio es muy pequeño frente al área del depósito).
Para ver el gráfico seleccione la opción "Descargar" del menú superior
Dato: la presión atmosférica es de 105 Pa ; g = 10 m/s2
Figura 8. Ejercicio
Solución:
Pº en el fondo (Pf) = Pº ATM + Pº ejercida por la placa + Pº de la columna de agua
PA = 105 Pa + (1200Kg 10m/s2)/12m2 = 1,01x105 Pa
Pº Fondo = 105Pa + (1200Kg 10m/s2)/12m2 + 1000Kg/m3 10m/s2*3,5
=1,36x10 5 Pa
Ya = 3m
Yb = 0 m
Va = 0 m/s
r<> agua = 1000 kg/m3
PB = 105 Pa
PA + ½ r V12 + r gy1 = PB + ½ r V22 + r gy2
1,01x105 Pa + 1000 Kg/m3 10 m/s2 3m = 105 Pa + ½ 1000 Kg/m3 Vb
Vb= 7,84 m/s
Restricciones a la ecuación de Bernoulli
Aunque la ecuación de Bernoulli es aplicable a una gran cantidad de problemas prácticos, existen algunas limitaciones que deben tener en cuanta con el fin de aplicar la ecuación de manera correcta.
- Es válida solamente para fluidos incompresibles, puesto que el peso específico del fluido se tomo como el mismo en las dos secciones de interés.
- No puede haber dispositivos mecánicos entre las dos secciones de interés que pudieran agregar o eliminar, ya que la ecuación establece que la energía total de un fluido es constante.
- No puede haber transferencia de calor hacia dentro o fuera del fluido.
- No puede haber pérdidas de energía debido a fricción.
6. Ley de Torricelli (velocidad de emisión)
Ejemplo programado:
Un tanque que contiene un líquido de densidad r tiene un agujero en uno de sus lados a una distancia Y1 del fondo (figura). El diámetro del agujero es pequeño comparado con el diámetro del tanque. El aire sobre el líquido se mantiene a una presión P. Determine la velocidad a la cual el fluido sale por el agujero cuando el nivel del líquido está a una distancia h arriba del agujero.
Para ver el gráfico seleccione la opción "Descargar" del menú superior
Figura 9. Ejercicio
Solución:
Debido a que A2 >> A1, el fluido está aproximadamente en reposo en la parte superior, punto 2. Al aplicar la ecuación de Bernoulli (ecc.17) a los puntos 1 y 2 y al notar que el agujero P1 = Po, obtenemos P1 + ½ r V12 + r gy1 = P + r gy2. Pero Y2 – Y1 = h, de manera que esto se reduce a
V1 = 2(P – Po) + 2gh ecc. 19
- r
- <>
La tasa de flujo del agujero es A1V1. Cuando P es grande comparada con la presión atmosférica Po (por lo tanto, puede ignorarse el término 2gh), la velocidad de la emisión es principalmente una función de P. Por último, si el tanque está abierto a la atmósfera, entonces P = Po y V1 = Ö 2gh. En otras palabras, la velocidad de la emisión para un tanque abierto es igual a la adquirida por un cuerpo que cae libremente a través de una distancia vertical h. Esto se conoce como la Ley de Torricelli.
7. Ecuación general de la energía
Con respecto a su efecto sobre un sistema de flujo, los dispositivos mecánicos, se pueden clasificar de acuerdo con la característica de si este entrega energía al fluido o si el fluido entrega energía al dispositivo.
Una bomba es un ejemplo común de un dispositivo mecánico que añade energía a un fluido. Un motor eléctrico o algún otro dispositivo principal de potencia hace funcionar un eje de la bomba. Esta entonces toma su energía cinética y la entrega al fluido, lo cual trae como resultado un aumento en la presión de fluido y este empieza a fluir.
7.1. Fricción de fluido
Un fluido en movimiento ofrece una resistencia de fricción al flujo. Parte de la energía del sistema se convierte en energía térmica (calor), el cual se disipa a través de las paredes del conducto en el que el fluido se desplaza. La magnitud de la pérdida energía depende de las propiedades del flujo, la velocidad de flujo, el tamaño del conducto, la rugosidad de la pared del conducto y la longitud del tubo.
7.2. Válvulas y conectores
Los elementos que controlan la dirección o la rapidez de flujo de un fluido en un sistema, típicamente establecen turbulencias locales en el fluido, coaccionando que la energía se disipe en forma de calor. Estas pérdidas de energía se presentan siempre que haya una restricción, un cambio de velocidad de flujo o un cambio de dirección. En un sistema grande, las pérdidas debidas a la presencia de válvulas y conectores son por lo general pequeña en comparación con las pérdidas por fricción en los conductos. Por consiguiente, a tales pérdidas se conoce como pérdidas menores.
7.3. Nomenclatura de pérdidas y adiciones de energía
Explicaremos las perdidas y las adiciones de energía en un sistema en términos de energía por unidad de peso o de fluido que fluye en el sistema. Como símbolo utilizaremos la letra h, cuando se hable de pérdidas y adiciones de energía.
hA = energía añadidas o agregada al fluido mediante un dispositivos mecánico
hR = energía removida o retirada del fluido mediante un dispositivo mecánico, como podría ser un motor de fluido.
HL = pérdida de energía por parte del sistema, debida a la fricción en los conductos o pérdidas menores debidas a la presencia de válvulas y conectores.
La magnitud de las pérdidas de energía producidas por muchos tipos de válvulas y de conectores es directamente proporcional a la velocidad del fluido. Lo anterior puede expresarse de manera matemática como:
hL = K(V2/2g) ecc. 20
Donde K es el coeficiente de resistencia, que por lo general se le encuentra experimentalmente. V es velocidad y g es gravedad.
La ecuación general de la energía
P1/g +Z1 +½ V12 /(2g) + hA – hR – hL = P2/g +Z2 +½ V22 /(2g) ecc. 21
Es de suma importancia que la ecuación general de la energía este escrita en la dirección de flujo, es decir, desde el punto de referencia, en la parte izquierda de la ecuación al punto correspondiente en el lado derecho. Los signos algebraicos juegan un papel crítico, debido a que el lado izquierdo de la ecuación 21 establece que un elemento de fluido que tenga una cierta cantidad de energía por unidad de peso en la sección 1, puede tener una adición de energía (+hA), una remoción de energía (-hR) o una pérdida de energía (-hL), antes de que alcance la sección 2. En tal punto contiene diferente energía por unidad de peso según lo indican los términos de la parte derecha de la ecuación.
En un problema particular, es posible que no todos los términos de la ecuación general de la energía se requieran. Por ejemplo si no hay un dispositivo mecánico entre las secciones de interés, los términos hA y hR serán cero, y puede sacarse de la ecuación.
Ejemplo programado:
De un recipiente grande fluye agua con una rapidez de 1,20 pies3/s a través de un sistema de conductos como el que se muestra en la figura 10. Calcule la cantidad total de energía perdida en el sistema debido a la presencia de la válvula, los codos, la entrada del tubo y la fricción del fluido.
Para ver el gráfico seleccione la opción "Descargar" del menú superior
Figura 10. Ejercicio Sistema de conductos
Utilizando un planteamiento similar usado con la ecuación de Bernoulli, elija las dos secciones de interés y escriba la ecuación general de la energía.
Solución:
El valor de algunos de estos términos es cero. Determine cuales de ellos son cero y simplifique la ecuación de la energía de acuerdo con ello.
P1 = 0 superficie del recipiente expuesta a la atmósfera
P2 = 0 corriente libre de fluido expuesta a la atmósfera
V1 = 0 insignificante debido a que el área del recipiente es grande
HA = hR = 0 no hay dispositivos mecánicos en el sistema
Entonces la ecuación queda Z1 – hL = Z2 + ½ V2/2g, puesto que estamos buscando la pérdida de energía total del sistema, resuelva esta ecuación para hL.
HL = (Z1-Z2) - V2/2g
Ahora evalúe los términos en el lado derecho de la ecuación para determinar hL en unidades lb-pie/lb.
(Z1-Z2) = 25 pies
Puesto que Q tiene un valor dado de 1,20 pies3/s el área de un chorro de 3 pulgadas de diámetro es de 0,0491 pies2, tenemos:
V2=Q/A2 1,20 /0,0491 = 24,4 pies/s
V2/2g = 24,42 pies2/s x s2/2x32 pies = 9,25 pies
hL = (Z1-Z2) - V2/2g = 25 pies - 9,25 pies = 15,75 pies ó 15,75 lb-pies/lb
Ejemplo programado:
La rapidez de flujo de volumen que pasa por la bomba que se muestra en la figura 11 es de 0,014 m3/s. El fluido que esta bombeando es aceite cuyo peso específico es 8,44 KN/m3. Calcule la energía transmitida por la bomba al aceite por unidad de peso de aceite que fluye en el sistema. Desprecie cualquier pérdida de energía en el sistema.
Para ver el gráfico seleccione la opción "Descargar" del menú superior
Figura 11. Sistema de bomba
Solución:
Deberá tener PA/g +ZA +½ VA2 /(2g) + hA = PA/g +ZB +½ VB2 /(2g) observe que los términos hR y hL fueron dejados fuera de la ecuación.
El objetivo del problema es calcular la energía agregada al aceite por parte de la bomba. Resuelva hA
HA = (PA – PB)/ g + (ZB-ZA)+ (V2B <>– V2A)/2g
Note que el tamaño del conducto es el mismo en las secciones. La rapidez de flujo de volumen en cada punto es igual también. Entonces, podemos concluir que vA = vB, por lo tanto (V2B <>– V2A)/2g es = cero
(PA – PB)/ g = [296 - ( - 28)] KN/m2 x m3 /8,44 Kn = 38,4 m
(ZB-ZA) = 1 metro
La energía agregada al sistema es :
hA =38, 4 m + 1,0 m + 0 = 39,4 Nxm/N, o sea que la bomba transmite 39,4 N x m a cada newton de aceite que fluye por ella.
7.4. Potencia requeridas por bombas
La potencias se define como la rapidez con que se realiza un trabajo. En mecánica de fluidos podemos modificar este enunciado y considerar que potencia es la rapidez con que la energía está siendo transferida. La unidad de potencia en el SI es el watt (W), que es equivalente a 1 Nm/s.
En el ejemplo programado anterior en encontramos que la bomba estaba transfiriendo 39,4 Nm/N Con el fin de calcular la potencia transferida, debemos determinar cuantos newton de aceite están fluyendo a determinado intervalo de tiempo dado por la bomba. A esto se le conoce como repidez de flujo de peso, W, se expresa en unidades de N/s. La potencia se calcula multiplicando la energía transferida por newton de fluido por la rapidez de flujo de peso. Es decir PA = hA W , donde W = g Q, por lo tanto la potencia agregada (PA) a un fluido por una bomba es
PA = hA g Q ecc.22
Siguiendo con el ejemplo anterior
hA = 39,4 Nm/N
g<> = 8,44 KN/m3
Q = 0,014 m3/s
PA = 4660 Nm/s = 4660 W = 4,66 KW
Como antecedente se tiene que 1 HP = 745,7 W = 550 lb/pies/s, por lo tanto la bomba tiene 6,24 HP.
7.4.1. Eficiencia mecánica de las bombas
El término eficiencia se utiliza para denotar el cociente de la potencia transmitida por la bomba de fluido entre la potencia suministrada a la bomba.
Debido a las perdidas de energía ocasionadas por la fricción mecánica en los componente de la bomba, la fricción del fluido de la misma y la excesiva turbulencia del fluido que se forma en ella, no toda la potencia suministrada a la bomba es trasmitida al fluido, entonces, utilizando el símbolo eM para representa la eficiencia, tenemos:
eM = Potencia agregada (PA)/Potencia puesta en la bomba(P1) ecc.23
Ejemplo programado:
Continuado con el ejemplo anterior, podríamos calcular la potencia puesta en la bomba, si conociéramos la eficiencia de ésta. Pero comercialmente este intervalo va desde 70 a 90 por ciento de eficiencia. Supongamos que en este caso es de el 82%. Por lo tanto
P1 = PA / eM = 4,66Kw/0,82 = 5,68 KW
Las eficiencias de las bombas no solo depende del diseño sino que también de las condiciones en la cuales está funcionando.
7.5. Potencia suministrada a motores de fluido
La energía transmitida por el fluido a un dispositivo mecánico, como a un motor de fluido a una turbina, esta representada en la ecuación general de la energía por el término hR, que es una medida de la energía transmitida por cada unidad de peso de fluido al tiempo que pasa por el dispositivo. Encontramos la potencia transmitida multiplicando hR por la rapidez de flujo peso, W. Por lo que la potencia removida de un fluido por un motor es:
PR = hRg Q ecc.24
7.5.1. Eficiencia mecánica de los motores de fluido
Des mismo modo en que lo describimos para las bombas, las pérdidas de un motor de fluido se producen por fricción mecánica y de fluido. Por consiguiente, no toda la potencia transmitida al motor es convertida a potencia de salida del dispositivo. La eficiencia mecánica se define como:
eMs = PR / P1 ecc.25
Aquí, de nuevo, el valor de eMs es siempre menor a 1,0.
Termodinámica
1. Temperatura
La temperatura es la sensación física que nos produce un cuerpo cuando entramos en contacto con él.
Observamos cambios en los cuerpos cuando cambian su temperatura, por ejemplo, la dilatación que experimenta un cuerpo cuando incrementa su temperatura. Esta propiedad se usa para medir la temperatura de un sistema. Pensemos en los termómetros que consisten en un pequeño depósito de mercurio que asciende por un capilar a medida que se incrementa la temperatura.
De una manera cualitativa, nosotros podemos describir la temperatura de un objeto como aquella determinada por la sensación de tibio o frío al estar en contacto con él.
Esto es fácil de demostrar cuando dos objetos se colocan juntos (los físicos lo definen como contacto térmico), el objeto caliente se enfría mientras que el más frío se calienta hasta un punto en el cual no ocurren más cambios, y para nuestros sentidos, ambos tienen el mismo grado de calor. Cuando el cambio térmico ha parado, se dice que los dos objetos (los físicos los definen más rigurosamente como sistemas) están en equilibrio térmico. Entonces podemos definir la temperatura de un sistema diciendo que la temperatura es aquella cantidad que es igual para ambos sistemas cuando ellos están en equilibrio térmico.
Si nuestro experimento fuese hecho con más de dos sistemas, encontraríamos que muchos sistemas pueden ser llevados a equilibrio térmico simultáneamente; el equilibrio térmico no depende del tipo de objeto usado. Pero siendo más preciso:
Si dos sistemas están separadamente en equilibrio térmico con un tercero, entonces ellos deben estar en equilibrio térmico entre sí.
y ellos tienen la misma temperatura sin tomar en cuenta el tipo de sistema que sean.
Lo expresado en letras itálicas es llamado Ley Cero de la Termodinámica y puede ser escrita más formalmente como:
"Si tres o más sistemas están en contacto térmico entre si y todos en equilibrio al mismo tiempo, entonces cualquier par que se tome separadamente están en equilibrio entre sí".
Ahora uno de los tres sistemas puede ser calibrado como un instrumento para medir temperatura, definiendo así un termómetro. Cuando uno calibra un termómetro, este se pone en contacto con el sistema hasta que alcanza el equilibrio térmico, obteniendo así una medida cuantitativa de la temperatura del sistema. Por ejemplo, un termómetro clínico de mercurio es colocado bajo la lengua del paciente y se espera que alcance el equilibrio térmico con su boca. Podemos ver como el líquido plateado (mercurio) se expande dentro del tubo de vidrio y se puede leer en la escala del termómetro para saber la temperatura del paciente.
¿Qué es un Termómetro?. Es un instrumento que mide la temperatura de un sistema en forma cuantitativa. Una forma fácil de hacerlo es encontrando una sustancia que tenga una propiedad que cambie de manera regular con la temperatura. La manera más "regular" es de forma lineal "t(x)=ax+b ", donde t es la temperatura y cambia con la propiedad x de la sustancia. Las constantes a y b dependen de la sustancia usada y deben ser evaluadas en dos puntos de temperatura específicos sobre la escala, por ejemplo, 32° para el punto congelamiento del agua y 212° para el punto de ebullición. Después se aclara que este es el rango de una escala ya conocida como la Fahrenheit.
Por ejemplo, el mercurio es líquido dentro del rango de temperaturas de -38,9° C a 356,7° C ( la escala Celsius se discute más adelante). Como un líquido, el mercurio se expande cuando se calienta, esta expansión es lineal y puede ser calibrada con exactitud.
1.1. El Desarrollo de Termómetros y Escalas de Temperaturas.
Uno de los primeros intentos para hacer un estándar de temperaturas ocurrió alrededor de AD 170, cuando Galeno ,en sus notas médicas, propone un estándar de temperatura "neutral" completando cantidades iguales para la ebullición del agua y el hielo. Sobre cualquier lado de esta temperatura tenía cuatro grados de calor y cuatro grados de frío respectivamente.
Los primeros equipos usados para medir la temperatura fueron llamado Termoscopios.
Para ver el gráfico seleccione la opción "Descargar" del menú superior
Figura 12. Termoscopios
Consistían en un bulbo de vidrio que tiene un largo tubo extendido hacia abajo colocado dentro de un recipiente que contiene agua con colorante (aunque Galileo en 1610 utilizó vino). Algo del aire contenido dentro del bulbo se expulsa, por lo cual el líquido se eleva a través del tubo para tomar su lugar. Como el aire remanente del bulbo se calienta o enfría, el nivel de líquido en el tubo varia reflejo del cambio de la temperatura del aire. Colocando una escala grabada sobre el tubo, se puede medir en forma cuantitativa estas fluctuaciones.
El aire dentro del bulbo es referido como medio termométrico, siendo aquel medio cuya propiedad cambia con la temperatura.
En 1641 el primer termómetro sellado que usó líquido en vez de aire como medio termométrico fue desarrollado por Ferdinand II, Gran Duque de Toscana. Su termómetro usó un equipo sellado en vidrio dentro del cual había alcohol, con 50 "grados" marcados sobre el tubo pero un "punto fijo" para el cero de la escala no fue utilizado, Estos fueron referidos como termómetros de "espíritu".
Robert Hook, párroco de la Sociedad Real, en 1664 usó un tinte rojo en alcohol. Su escala, para la cual todos los grado representaban un igual incremento de volumen equivalente alrededor de 1/500 partes de el volumen del líquido del termómetro, necesitó solo un punto fijo. El seleccionó el punto de congelamiento del agua. Por una escala presentada de esta manera, Hook presentó que un mismo estándar puede ser establecido para termómetros de tamaños diferentes. El termómetro original de Hook quedó conocido como un estándar del Gresham College y fue usado por la Sociedad Real hasta 1709. (El primer registro meteorológico inteligible usó esta escala).
En 1702, el astrónomo Ole Roemer de Copenhagen basó su escala en dos puntos fijos: nieve (o hielo comprimido) y el punto de ebullición del agua, y registró la temperatura diaria en Copenhagen desde 1708 a 1709 con su termómetro.
Fue en 1724 que Gabriel Fahrenheit usó mercurio como liquido termométrico. La expansión térmica del mercurio es amplia y suavemente uniforme, esto permite que no se adhiera a el vidrio y permanece líquido ante un amplio rango de temperaturas. Su apariencia plateada hace que sea fácil de leer. Fahrenheit describió como calibró la escala de mercurio de su termómetro de la siguiente manera:
" Colocando el termómetro en un mezcla de sal de amonio o agua salada, hielo, y agua, un punto sobre la escala pudo ser encontrado el cual llamé cero. Un segundo punto fue obtenido de la misma manera, si la mezcla es usada sin sal. Denotando este punto como 30. Un tercer punto designado como 96 fue obtenido colocando el termómetro en la boca para adquirir el calor del cuerpo humano."
Sobre esta escala, Fahrenheit midió el punto de ebullición del agua obteniendo 21 2. Después adjudicó el punto de congelamiento del agua a 32 así que el intervalo entre el punto de congelamiento y ebullición del agua puede ser representado por el número racional 180. Temperaturas medidas sobre esta escala son designadas como grados Fahrenheit (°F).
En 1745 Carlos Linneo de Upsala, Suecia, describió una escala en la cual el punto de congelamiento del agua era 100 y el punto de ebullición cero haciendo esto una escala centígrada. Anders Celsius (1701-1744) usó la escala al revés en la cual cero representó el punto de congelamiento y 100 el punto de ebullición del agua, manteniendo los 100 grados entre los dos puntos. En 1948 el término Grado Centígrado fue reemplazado por el de Grados Celsius. Temperaturas medidas sobre una escala centígrada, con el punto de congelamiento del agua como cero, son designadas como grados Celsius (°C).
Para convertir de grado Centígrado a Fahrenheit multiplique por 1,8 y sume 3 2.
°F=1,8° C+32. ecc.26
En 1780, J.A. C. Charles, físico francés, presentó que para un mismo incremento de temperatura, todos los gases tienen el mismo aumento de volumen. Porque los coeficientes de expansión de los gases son tal que están muy cerca uno del otro, con esto es posible establecer una escala de temperatura basada en un solo punto fijo en vez de dos, tal como en la Fahrenheit o Celsius. Esto nos lleva a termómetro que usen gas como medio termométrico.
Para ver el gráfico seleccione la opción "Descargar" del menú superior
Figura 13. Termómetro de gas
En este termómetro de gas a volumen constante el bulbo B que contiene hidrógeno (por ejemplo) bajo un cierta presión ,se conecta con un manómetro de mercurio por medio de un tubo de volumen muy pequeño. (El bulbo B es la porción sensible a la temperatura y debe procurarse que todo sea de mercurio). El nivel de mercurio en C puede adjudicarse al elevarse o no el nivel en el reservorio R. La presión del hidrógeno la cual es "x" varía en relación lineal con la temperatura, es la diferencia entre los niveles D y C más la presión encima de D.
P. Chappuis in 1887 dirigió extensos estudios sobre los termómetros de gas con presión constante o con volumen constante usando hidrógeno, nitrógeno y bióxido de carbono como medios termométricos. Basado en estos resultados, el Comite Internacional de Pesos y Medidas adoptó la escala de hidrógeno a volumen constante tomando como puntos fijos el punto de hielo (0° C) y de vapor (100° C) como escala práctica para la meteorología internacional.
Experimentos con termómetros de gas han divulgado que es muy pequeña la diferencia en la lectura de temperaturas utilizando diferentes gases. Así es posible, fijar una escala de temperatura que sea independiente del medio termométrico si este es un gas a baja presión. En este caso, todos los gases se comportan como un gas ideal y tienen una relación muy simple entre la presión, temperatura y volumen: "pV=(constante)T. "
Esta temperatura es llamada temperatura termodinámica y es aceptada en la actualidad como medida fundamental de temperatura. Note que hay una definición natural del cero en esta escala; es el punto donde la presión del gas ideal se hace cero, por lo tanto la temperatura es cero. La discusión sobre el cero absoluto se hará posteriormente. En 1933, El Comité Internacional de Pesos y Medidas adoptó como punto fijo el punto triple del agua, (la temperatura a la cual el agua el hielo, agua líquido y vapor coexisten en equilibrio), este valor es 273,16, la unidad de temperatura de esta escala fue llamada Kelvin, por Lord Kelvin (Williams Thompson) 1824-1907, y su símbolo es K. (no utiliza grados).
Para convertir de Celsius a Kelvin sumo 273,16:
K=°C+273,16 ecc.27
Temperatura Termodinámica es la temperatura fundamental, su unidad es el Kelvin la cual se define como una fracción de 1/273,16 de la temperatura termodinámica del punto triple del agua.
Sir William Siemens en 1871 propuso un termómetro donde medio termométrico es un conductor metálico cuya resistencia cambia con la temperatura. El platino no se oxida a altas temperaturas y tiene un cambio relativamente uniforme con la temperatura en un amplio rango. El termómetro de resistencia de platino es ampliamente usado como termómetro termoeléctrico y cubre un rango de temperaturas que va desde -260° C a 1235° C.
Algunas temperatura fueron adoptadas como Referencias Primarias tal como las definió la Escala Internacional de Temperaturas Prácticas en 1968. La Escala de Internacional de Temperaturas en 1990 adoptó por el Comité Internacional de Pesos y Medidas los siguientes estándares mantenidos desde 1989. Entre 0,65K y 5,0 K, la temperatura se definió en términos de la presión de vapor (relación de temperaturas del isótopo de Helio). Entre 3,0 K y el punto triple del Neón (24,5561 K) la temperatura se definió por medio de un termómetro de gas (Helio). Entre el punto triple del hidrógeno (13,8033 K) y el punto de congelamiento de la plata (961,78 oC) la temperatura se definió por medio de termómetros de resistencia de platino. Por encima del punto de congelamiento de la plata la temperatura se definió en términos de la Ley de Radiación de Planck.
T.J. Seebeck en 1826 descubrió que cuando alambres de diferentes metales son fusionados en un terminal y calentados, fluye corriente de uno a otro. La fuerza electromotriz generada puede ser cuantitativamente relacionada con la temperatura y así el sistema puede ser usado como termómetro, conocido como termocouple. La termocouple es usada en la industria y diferentes metales son usados: níquel / aluminio y platino / platino-rodio, por ejemplo. El Instituto Nacional de Estándares y Tecnologías (NIST) mantiene bases de datos para estandarizar termómetros.
Para las medidas a muy bajas temperaturas, la susceptibilidad magnética de una sustancia paramagnética es usada como una cantidad física termométrica. Para algunas sustancias, la susceptibilidad magnética varía inversamente con la temperatura. Cristales como (cerrous magnesium nitrate y chromic potassum alum) han sido usados para medir temperaturas por debajo de 0,05 K; estos cristales son calibrados en un rango de helio líquido. Este diagrama y las últimas ilustraciones de este texto fueron tomadas del archivo de imágenes del Laboratorio de Bajas Temperaturas de la Universidad Tecnológica de Helsinki. Para estas temperaturas tanto o más bajas que estas, el termómetro es también usado como mecanismo de enfriamiento. Algunos laboratorios de bajas temperaturas conducen interesantes aplicaciones e investigaciones teóricas sobre como alcanzar la temperatura más baja posible, como trabajarlas y encontrarle aplicaciones.
2. Ley de los gases ideales (ecuación de estado)
Según la teoría atómica las moléculas pueden tener o no cierta libertad de movimientos en el espacio; estos grados de libertad microscópicos están asociados con el concepto de orden macroscópico. Las libertad de movimiento de las moléculas de un sólido está restringida a pequeñas vibraciones; en cambio, las moléculas de un gas se mueven aleatoriamente, y sólo están limitadas por las paredes del recipiente que las contiene.
Se han desarrollado leyes empíricas que relacionan las variables macroscópicas en base a las experiencias en laboratorio realizadas. En los gases ideales, estas variables incluyen la presión ( p), el volumen (V) y la temperatura (T).
La ley de Boyle - Mariotte relaciona inversamente las proporciones de volumen y presión de un gas, manteniendo la temperatura constante:
P1. V1 = P2 . V2<> ecc.28
La ley de Gay-Lussac afirma que el volumen de un gas, a presión constante, es directamente proporcional a la temperatura absoluta:
V1/T1=V2/T2<> ecc.29
La ley de Charles sostiene que, a volumen constante, la presión de un gas es directamente proporcional a la temperatura absoluta del sistema:
P1/T1=P2/T2 ecc.30
En ambos casos la temperatura se mide en kelvin (273 ºK = 0ºC) ya que no podemos dividir por cero, no existe resultado.
De las tres se deduce la ley universal de los gases:
P1/T1=P2/T2 =V1/T1=V2/T2<> = (P1V1)/T1 = (P2V2)/T2<> ecc.31
3. Teoría Cinética de los Gases
El comportamiento de los gases, enunciadas mediante las leyes anteriormente descriptas, pudo explicarse satisfactoriamente admitiendo la existencia del átomo.
El volumen de un gas: refleja simplemente la distribución de posiciones de las moléculas que lo componen. Más exactamente, la variable macroscópica V representa el espacio disponible para el movimiento de una molécula.
La presión de un gas, que puede medirse con manómetros situados en las paredes del recipiente, registra el cambio medio de momento lineal que experimentan las moléculas al chocar contra las paredes y rebotar en ellas.
La temperatura del gas es proporcional a la energía cinética media de las moléculas, por lo que depende del cuadrado de su velocidad.
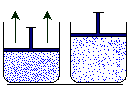
Figura 14. Comportamiento de los gases
La reducción de las variables macroscópicas a variables mecánicas como la posición, velocidad, momento lineal o energía cinética de las moléculas, que pueden relacionarse a través de las leyes de la mecánica de Newton, debería de proporcionar todas las leyes empíricas de los gases. En general, esto resulta ser cierto.
La teoría física que relaciona las propiedades de los gases con la mecánica clásica se denomina teoría cinética de los gases. Además de proporcionar una base para la ecuación de estado del gas ideal. La teoría cinética también puede emplearse para predecir muchas otras propiedades de los gases, entre ellas la distribución estadística de las velocidades moleculares y las propiedades de transporte como la conductividad térmica, el coeficiente de difusión o la viscosidad.
3.1. Densidad de un gas
En un determinado volumen las moléculas de gas ocupan cierto espacio. Si aumenta el volumen (imaginemos un globo lleno de aire al que lo exponemos al calor aumentando su temperatura), la cantidad de moléculas (al tener mayor espacio) se distribuirán de manera que encontremos menor cantidad en el mismo volumen anterior. Podemos medir la cantidad de materia, ese número de moléculas, mediante una magnitud denominada masa. La cantidad de moléculas, la masa, no varía al aumentar o disminuir (como en este caso) el volumen, lo que cambia es la relación masa - volumen. Esa relación se denomina densidad (ρ). La densidad es inversamente proporcional al volumen (al aumentar al doble el volumen , manteniendo constante la masa, la densidad disminuye a la mitad) pero directamente proporcional a la masa (si aumentamos al doble la masa, en un mismo volumen, aumenta al doble la densidad).
ρ = m/V ecc.32
3.2. Hipótesis de Avogadro
Esta hipótesis establece que dos gases que posean el mismo volumen (a igual presión y temperatura) deben contener la misma cantidad de moléculas.
Cada molécula, dependiendo de los átomos que la compongan, deberán tener la misma masa. Es así que puede hallarse la masa relativa de un gas de acuerdo al volumen que ocupe. La hipótesis de Avogadro permitió determinar la masa molecular relativa de esos gases.
Analicemos el orden lógico que siguió:
- La masa de 1 litro de cualquier gas es la masa de todas las moléculas de ese gas.
- Un litro de cualquier gas contiene el mismo número de moléculas de cualquier otro gas
- Por lo tanto, un litro de un gas posee el doble de masa de un litro otro gas si cada molécula del primer gas pesa el doble de la molécula del segundo gas.
- En general las masas relativas de las moléculas de todos los gases pueden determinarse pesando volúmenes equivalentes de los gases.
En condiciones normales de presión y temperatura (CNPT) [ P = 1 atm y T = 273 ºK ] un litro de hidrógeno pesa 0,09 g y un litro de oxígeno pesa 1,43 g. Según la hipótesis de Avogadro ambos gases poseen la misma cantidad de moléculas. La proporción de los pesos entre ambos gases es: 1,43 : 0,09 = 15,9 (aproximadamente) 16. Es la relación que existe entre una molécula de oxígeno e hidrógeno es 16 a 1. Las masas atómicas relativas que aparecen en la tabla periódica están consideradas a partir de un volumen de 22,4 litros en CNPT.
3.3. Ley de los Gases Generalizada
Como consecuencia de la hipótesis de Avogadro puede considerarse una generalización de la ley de los gases. Si el volumen molar (volumen que ocupa un mol de molécula de gas) es el mismo para todos los gases en CNPT, entonces podemos considerar que el mismo para todos los gases ideales a cualquier temperatura y presión que se someta al sistema. Esto es cierto por que las leyes que gobiernan los cambios de volumen de los gases con variaciones de temperatura y presión son las mismas para todos los gases ideales.
Se denomina ecuación de estado a la relación que existe entre las variables p, V, y T. La ecuación de estado más sencilla es la de un gas ideal
pV=nRT ecc. 33
, donde n representa el número de moles, R la constante de los gases R=0,082 atm·l/(K mol) ó (8,31 J/mol*K) y T (grados kelvin).
4. Calorimetría y Termodinámica
La Termodinámica campo de la física que describe y relaciona las propiedades físicas de sistemas macroscópicos (conjunto de materia que se puede aislar espacialmente y que coexiste con un entorno infinito e imperturbable) de materia y energía. El estado de un sistema macroscópico en equilibrio puede describirse mediante variables termodinámicas, propiedades medibles como la temperatura, la presión o el volumen. Es posible identificar y relacionar entre sí muchas otras variables (como la densidad, el calor específico, la compresibilidad o el coeficiente de expansión térmica), con lo que se obtiene una descripción más completa de un sistema y de su relación con el entorno. Cuando un sistema macroscópico pasa de un estado de equilibrio a otro, se dice que tiene lugar un proceso termodinámico.
Calor una forma de energía: Cuando dos sistemas, a temperaturas diferentes, se ponen en contacto, la temperatura final que ambos alcanzan tiene un valor intermedio entre las dos temperaturas iniciales. Ha habido una diferencia de temperatura en estos sistemas. Uno de ellos ha perdido "calor" (su variación de temperatura es menor que cero ya que la temperatura final es menor que la inicial) y el otro ha ganado "calor" (su variación de temperatura es positiva). La cantidad de calor (cedida uno al otro) puede medirse, es una magnitud escalar que suele ser representada mediante la letra Q. Las unidades para medir el calor son la caloría, kilo caloría (1000 cal), etc.
La caloría puede definirse como la "cantidad de calor" necesaria para elevar en un grado de temperatura, un gramo (masa) de materia: 1 cal / 1ºC.1 g
Durante mucho tiempo se pensó que el calor era una especie de "fluido" que pasaba de un cuerpo a otro. Hoy se sabe que el calor es una onda electromagnética (posee la misma naturaleza que la luz) y su emisión depende de la vibración de los electrones de los átomos que forman el sistema (véase mecánica cuántica).
4.1. Capacidad calórica y Calor específico
Las sustancias difieren entre sí en la cantidad de calor que se necesita para producir, en una unidad de masa dada, un determinado aumento de temperatura. La relación directamente proporcional entre la variación de la cantidad de calor (ΔQ) y la variaciσn de temperatura (ΔT) se denomina capacidad calórica.
C = ΔQ / ΔT
Atención: la palabra capacidad puede sugerir, erróneamente, que creamos que nos referimos a "la cantidad de calor que un cuerpo puede contener", mientras que lo que realmente significa es el calor añadido por unidad de aumento de temperatura.
Decimos que una cantidad de calor D Q se transfiere desde el sistema de mayor temperatura al sistema de menor temperatura.
La cantidad de calor transferida es proporcional al cambio de temperatura D T.
La constante de proporcionalidad C se denomina capacidad calorífica del sistema.
D Q=C·D T ecc.34
Si los cuerpos A y B son los dos componentes de un sistema aislado, el cuerpo que está a mayor temperatura transfiere calor al cuerpo que está a menos temperatura hasta que ambas se igualan. Si TA>TB
El cuerpo A cede calor: D QA=CA·(T-TA), entonces D QA<0
El cuerpo B recibe calor: D QB=CB·(T-TB), entonces D QB<0
Como D QA+D QB=0. La temperatura de equilibrio, se obtiene mediante la media ponderada
T = (CATA+CBTB)/(CA+CB) ecc. 35
La capacidad calorífica de la unidad de masa se denomina calor específico c.
C = mc
La fórmula para la transferencia de calor entre los cuerpos se expresa en términos de la masa m del calor específico c y del cambio de temperatura.
D Q=m·c·(Tf-Ti) ecc.36
donde Tf es la temperatura final y Ti es la temperatura inicial.
El calor específico es la cantidad de calor que hay que suministrar a un gramo de una sustancia para que eleve en un grado centígrado su temperatura. Joule demostró la equivalencia entre calor y trabajo 1cal=4.186 J. Por razones históricas la unidad de calor no es la misma que la de trabajo, el calor se suele expresar en calorías.
El calor específico del agua es c=1 cal/(g ºC). Hay que suministrar una caloría para que un gramo de agua eleve su temperatura en un grado centígrado.
Fundamentos físicos
Cuando varios cuerpos a diferentes temperaturas se encuentran en un recinto adiabático se producen intercambios caloríficos entre ellos alcanzándose la temperatura de equilibrio al cabo de cierto tiempo. Cuando se ha alcanzado este equilibrio se debe cumplir que la suma de las cantidades de calor intercambiadas es cero.
Se define calor específico "c" como la cantidad de calor que hay que proporcionar a un gramo de sustancia para que eleve su temperatura en un grado centígrado. En el caso particular del agua c vale 1 cal/(g ºC) ó 4186 J(kg ºK).
La unidad de calor específico que más se usa es cal/(g ºC) sin embargo, debemos de ir acostumbrándonos a usar el Sistema Internacional de Unidades de Medida, y expresar el calor específico en J/(kg ºK). El factor de conversión es 4186.
CUADRO 3. Calor específico de algunos elementos
Sustancia | Calor específico (J/kg·K) |
Acero | 460 |
Aluminio | 880 |
Cobre | 390 |
Estaño | 230 |
Hierro | 450 |
Mercurio | 138 |
Oro | 130 |
Plata | 235 |
Plomo | 130 |
Sodio | 1300 |
La cantidad de calor recibido o cedido por un cuerpo se calcula mediante la siguiente fórmula
Q=m·c·(Tf-Ti) ecc.37
Donde m es la masa, c es el calor específico, Ti es la temperatura inicial y Tf la temperatura final
- Si Ti>Tf el cuerpo cede calor Q<0
- Si Ti el cuerpo recibe calor Q>0
4.2. Cambios de estado
Normalmente, una sustancia experimenta un cambio de temperatura cuando absorbe o cede calor al ambiente que le rodea. Sin embargo, cuando una sustancia cambia de fase absorbe o cede calor sin que se produzca un cambio de su temperatura. El calor Q que es necesario aportar para que una masa m de cierta sustancia cambie de fase es igual a
Q=mL ecc. 38
donde L se denomina calor latente de la sustancia y depende del tipo de cambio de fase.
Por ejemplo, para que el agua cambie de sólido (hielo) a líquido, a 0ºC se necesitan 334x103 J/kg. Para que cambie de líquido a vapor a 100 ºC se precisan 2260·103 J/kg.
En la siguiente tabla, se proporcionan los datos referentes a los cambios de estado de algunas sustancias.
CUADRO 4. Datos referentes a los cambios de estado de algunas sustancias
Sustancia | T fusión ºC | Lf ·103 (J/kg) | T ebullición ºC | Lv ·103 (J/kg) |
Hielo (agua) | 0 | 334 | 100 | 2260 |
Alcohol etílico | -114 | 105 | 78.3 | 846 |
Acetona | -94.3 | 96 | 56.2 | 524 |
Benceno | 5.5 | 127 | 80.2 | 396 |
Aluminio | 658.7 | 322-394 | 2300 | 9220 |
Estaño | 231.9 | 59 | 2270 | 3020 |
Hierro | 1530 | 293 | 3050 | 6300 |
Cobre | 1083 | 214 | 2360 | 5410 |
Mercurio | -38.9 | 11.73 | 356.7 | 285 |
Plomo | 327.3 | 22.5 | 1750 | 880 |
Potasio | 64 | 60.8 | 760 | 2080 |
Sodio | 98 | 113 | 883 | 4220 |
Los cambios de estado se pueden explicar de forma cualitativa del siguiente modo:
En un sólido los átomos y moléculas ocupan las posiciones fijas de los nudos de una red cristalina. Un sólido tiene en ausencia de fuerzas externas un volumen fijo y una forma determinada.
Los átomos y moléculas vibran, alrededor de sus posiciones de equilibrio estable, cada vez con mayor amplitud a medida que se incrementa la temperatura. Llega un momento en el que vencen a las fuerzas de atracción que mantienen a los átomos en sus posiciones fijas y el sólido se convierte en líquido. Los átomos y moléculas siguen unidos por las fuerzas de atracción, pero pueden moverse unos respecto de los otros, lo que hace que los líquidos se adapten al recipiente que los contiene pero mantengan un volumen constante.
Cuando se incrementa aún más la temperatura, se vencen las fuerzas de atracción que mantienen unidos a los átomos y moléculas en el líquido. Las moléculas están alejadas unas de las otras, se pueden mover por todo el recipiente que las contiene y solamente interaccionan cuando están muy próximas entre sí, en el momento en el que chocan. Un gas adopta la forma del recipiente que lo contiene y tiende a ocupar todo el volumen disponible.
Un ejemplo clásico en el que se usan los conceptos de calor específico y calor latente es el siguiente:
Determinar el calor que hay que suministrar para convertir 1g de hielo a -20 ºC en vapor a 100ºC. Los datos son los siguientes:
- Calor específico del hielo ch=2090 J/(kg K)
- Calor de fusión del hielo Lf=334·103 J/kg
- Calor específico del agua c=4180 J/(kg K)
- Calor de vaporización del agua Lv=2260·103 J/kg
Etapas:
- Se eleva la temperatura de 1g de hielo de -20ºC a 0ºC
Q1=0,001 x 2090 x(0-(-20))=41,8 J
- Se funde el hielo
Q2=0,001 x 334x103 =334 J
- Se eleva la temperatura del agua de 0º C a 100 ºC
Q3=0,001x4180x(100-0)=418 J
- Se convierte 1 g de agua a 100ºC en vapor a la misma temperatura
Q4=0,001 x 2260x103=2260 J
El calor total Q=Q1+Q2+Q3+Q4=3053,8 J.
Figura 15. Diagrama de proceso de cambio de fase Hielo - Vapor
En la figura 15, se muestra cómo se va incrementando la temperatura a medida que se aporta calor al sistema. La vaporización del agua requiere de gran cantidad de calor como podemos observar en la gráfica (no está hecha a escala) y en los cálculos realizados en el ejemplo.
Si disponemos de una fuente de calor que suministra una energía a razón constante de q J/s podemos calcular la duración de cada una de las etapas
Los sistemas físicos que encontramos en la Naturaleza consisten en un agregado de un número muy grande de átomos.
La materia está en uno de los tres estados: sólido, líquido o gas: En los sólidos, las posiciones relativas (distancia y orientación) de los átomos o moléculas son fijas. En los líquidos las distancias entre las moléculas son fijas, pero su orientación relativa cambia continuamente. En los gases, las distancias entre moléculas, son en general, mucho más grandes que las dimensiones de las mismas. Las fuerzas entre las moléculas son muy débiles y se manifiestan principalmente en el momento en el que chocan. Por esta razón, los gases son más fáciles de describir que los sólidos y que los líquidos.
El gas contenido en un recipiente, está formado por un número muy grande de moléculas, 6,02x1023 moléculas en un mol de sustancia. Cuando se intenta describir un sistema con un número tan grande de partículas resulta inútil (e imposible) describir el movimiento individual de cada componente. Por lo que mediremos magnitudes que se refieren al conjunto: volumen ocupado por una masa de gas, presión que ejerce el gas sobre las paredes del recipiente y su temperatura. Estas cantidades físicas se denominan macroscópicas, en el sentido de que no se refieren al movimiento individual de cada partícula, sino del sistema en su conjunto.
4.3. Transferencia de calor
Transferencia de energía causada por la diferencia de temperatura entre dos partes adyacentes de un cuerpo. El calor se transfiere mediante convección, radiación o conducción. Aunque estos tres procesos pueden tener lugar simultáneamente, puede ocurrir que uno de los mecanismos predomine sobre los otros dos.
Conducción: es la única forma de transferencia de calor en los sólidos.
Si consideramos una lámina cuya área de sección recta sea A y espesor (Δx), expuesta a diferentes temperaturas (ΔT) en cada una de sus caras, se puede medir la cantidad de calor (ΔQ) que fluye perpendicularmente a las caras en un determinado tiempo (Δt). La relaciσn (directamente proporcional) entre cantidad de calor (ΔQ) y el tiempo (Δt) determina la velocidad de transmisión (v) del calor a través del área A; mientras que la relación (directamente proporcional) entre la variación de temperatura (ΔT) y el espesor (Δx) se llama gradiente de temperatura. La igualdad se obtiene mediante una constante de proporcionalidad (k) llamada conductividad térmica.
ΔQ/Δt = - KA (ΔT/Δx)
La dirección de flujo del calor será aquella en la que aumenta x; como el calor fluye en dirección en que disminuye T, se introduce un signo menos en la ecuación. Lo que significa que ΔQ/Δt es positiva cuando ΔT/Δx es negativa.
También puede aplicarse esta ecuación a una varilla metálica de longitud L y sección transversal constante A en la cual se ha alcanzado un estado estacionario (la temperatura en cada uno de los extremos es constante en el tiempo), por consiguiente, la temperatura decrece linealmente a lo largo de la varilla.
ΔQ/Δt = - KA (ΔT/L)
Los materiales como el oro, la plata o el cobre tienen conductividades térmicas elevadas y conducen bien el calor, mientras que materiales como el vidrio o el amianto tienen conductividades cientos e incluso miles de veces menores; conducen muy mal el calor, y se conocen como aislantes.
4.4. Convección
Si existe una diferencia de temperatura en el interior de un fluido (líquido o un gas) es casi seguro que se producirá un movimiento llamado convección.
Si se calienta un líquido o un gas, su densidad (masa por unidad de volumen) suele disminuir, el fluido más caliente y menos denso asciende, mientras que el fluido más frío y más denso desciende. Este tipo de movimiento, debido exclusivamente a la no uniformidad de la temperatura del fluido, se denomina convección natural. La convección forzada se logra sometiendo el fluido a un gradiente de presiones, con lo que se fuerza su movimiento de acuerdo a las leyes de la mecánica de fluidos.
Si calentamos una cacerola llena de agua, el líquido más próximo al fondo se calienta por el calor que se ha transmitido por conducción a través de la cacerola. Al expandirse, su densidad disminuye y como resultado de ello el agua caliente asciende y parte del fluido más frío baja hacia el fondo, con lo que se inicia un movimiento de circulación. El líquido más frío vuelve a calentarse por conducción, mientras que el líquido más caliente situado arriba pierde parte de su calor por radiación y lo cede al aire situado por encima.
4.5. Radiación
La radiación presenta una diferencia fundamental respecto a la conducción y la convección: las sustancias que intercambian calor no tienen que estar en contacto, sino que pueden estar separadas por un vacío. La vibración de los electrones (salto cuántico) está determinada por la cantidad de energía absorbida. Esta energía es liberada en forma de radiación (luz, calor, rayos x) dependiendo de la energía de estimulación administrada.
4.6. Equivalente mecánico del Calor
Si el calor es precisamente otra forma de energía, cualquier unidad de energía puede ser una unidad de calor. El tamaño relativo de las "unidades de calor" y las "unidades mecánicas" puede encontrarse a partir de los experimentos en los cuales una cantidad conocida de energía mecánica, medida en joules, se añade al sistema (recipiente de agua, por ejemplo). Del aumento de temperatura medido puede calcularse cuanto calor (en calorías) tendremos que añadir a la muestra de agua para producir el mismo efecto. De esa manera puede calcularse la relación entre Joule y calorías, es decir, el llamado equivalente mecánico del calor.
Originalmente Joule utilizó un aparato en el cual unas pesas, al caer, hacían girar un conjunto de paletas sumergidas en agua. La pérdida de energía mecánica (debido al rozamiento) se calculaba conociendo las pesas y las alturas de las cuales caían. La energía calórica equivalente era determinada a través de la masa de agua y su aumento de temperatura.
Los resultados aportados fueron: 1 kcal = 1000 cal = 4186 joules.
Es decir 4186 Joules de energía elevarán la temperatura de 1 Kg. de agua en 1 ºC, lo mismo que 1000 calorías.
1 Kcal = 4186 J , 1 cal = 4,186 J , 0,24 cal = 1 J |
4.7. Calor y Trabajo
Ni el calor ni el trabajo son propiedades de un cuerpo en el sentido de poder asignarle un valor a la cantidad "contenida" en el sistema. El trabajo es una medida de la energía trasferida por medios mecánicos mientras que el calor, en cambio, es una medida de la energía transferida por medio de una diferencia de temperatura.
La Termodinámica estudia la transferencia de energía que ocurre cuando un sistema sufre un determinado proceso (termodinámico) que produce un cambio llevando de un estado a otro del sistema
<>
Figura 16. Trabajo mecánico
Si aplicamos una fuerza sobre una superficie obtendremos una presión sobre ese lugar. La fuerza aplicada, al provocar un desplazamiento, genera trabajo mecánico. En el caso de la presión, que actúa sobre las paredes de un cuerpo extensible, el ensanchamiento de este produce variación de volumen, el que está asociado con el trabajo mecánico también.
F = Pr.Sup
W = (Pr. Sup Δx )à ΔV = W = PrΔV
W = F Δx
4.8. Ley Cero
Si dos sistemas distintos están en equilibrio termodinámico con un tercero, también tienen que estar en equilibrio entre sí.
Si uno de estos sistemas se pone en contacto con un entorno infinito situado a una determinada temperatura, el sistema acabará alcanzando el equilibrio termodinámico con su entorno, es decir, llegará a tener la misma temperatura que éste. (El llamado entorno infinito es una abstracción matemática denominada depósito térmico; en realidad basta con que el entorno sea grande en relación con el sistema estudiado).
4.9. Primera Ley
Analicemos una situación imaginaria para redondear una idea: si tenemos un sistema que cambie de un estado inicial de equilibrio i, a un estado final de equilibrio f, en un forma determinada, tendremos a Q como el calor absorbido por el sistema y W como el trabajo hecho por el sistema; después calculamos el valor de Q – W. Ahora, cambiemos el sistema manteniendo, por supuesto, el mismo estado i para llegar hasta el estado final f, pero en esta ocasión utilizamos un camino diferente. Repetimos el procedimiento una y otra vez usando diferentes caminos en cada caso. Nos encontramos que en todos los intentos Q – W mantiene su valor numérico siempre igual. La explicación se debe a que: aunque la magnitud de Q y W, separadamente, dependen del camino tomado, Q – W no depende de cómo pasamos de un estado a otro, sino sólo de ambos estados, el inicial y el final (de equilibrio).
Por lo visto en mecánica, que cuando un objeto se mueve de un punto a otro en un campo gravitacional en ausencia de fricción, el trabajo hecho depende solo de las posiciones de los puntos y no de la trayectoria por la que el cuerpo se mueve. Podemos concluir que hay una energía potencial, en función de las coordenadas espaciales del cuerpo, cuya diferencia entre su valor final y su valor inicial es igual al trabajo hecho al desplazar el cuerpo. En termodinámica se encuentra experimentalmente que, cuando en un sistema ha cambiado su estado i al f, la cantidad Q – W dependen solo de las coordenadas iniciales y finales y no del camino tomado entre estos puntos extremos. Se concluye que hay una función de las coordenadas termodinámicas cuyo valor final menos su valor inicial es igual al cambio Q – W en el proceso. A esta función le llamamos función de la energía interna (la que se representa mediante la letra U)
La diferencia entre la energía interna del sistema en el estado f (U f ) y el estado inicial i (Ui) es solo el cambio de energía interna del sistema, y esta cantidad tiene un valor determinado independientemente de la forma en que el sistema pasa del estado i al estado f: Tenemos entonces que
U f – U i. = ΔU = Q – U ecc.39
Como sucede con la energía potencial, también para que la energía interna, lo que importa es su cambio. Esta ecuación se conoce como la primera ley de la termodinámica, al aplicarla debemos recordar que Q se considera positiva cuando el calor entra al sistema y que W será positivo cuando el trabajo lo hace el sistema. A la función interna U, se puede ver como muy abstracta en este momento. En realidad, la termodinámica clásica no ofrece una explicación para ella, además es una función de estado que cambia en una forma predecible. La primera ley de la termodinámica, se convierte entonces en un enunciado de la ley de la conservación de la energía para los sistemas termodinámicos. La energía total de un sistema de partículas (U), cambia en una cantidad exactamente igual a la cantidad que se le agrega al sistema, menos la cantidad que se le quita.
El hecho que consideremos que el valor de Q sea positivo cuando el calor entra al sistema y que W sea positivo cuando la energía sale del sistema como trabajo está determinado por el estudio de las máquinas térmicas, que provocó inicialmente el estudio de la termodinámica. Simplemente es una buena forma económica tratar de obtener el máximo trabajo con una maquina de este tipo, y minimizar el calor que debe proporcionársele a un costo importante. Estas naturalmente se convierten en cantidades de interés.
Si nuestro sistema sólo sufre un cambio muy pequeño, infinitesimal, en su estado, se absorbe nada más una cantidad infinitesimal de calor y se hace solo una cantidad infinitesimal de trabajo, de tal manera que el cambio de energía interna también es infinitesimal. Aunque la cantidad infinitesimal de trabajo y la cantidad infinitesimal de calor no son diferencias exactas (el por que va más allá de este apunte por lo que deberá acceder a un texto de termodinámica avanzado), podemos escribir la primera ley diferencial en la forma: dU = dQ – dW.
Podemos definir la primera ley diciendo: todo sistema termodinámico en un estado de equilibrio, tiene una variable de estado llamada energía interna U cuyo cambio dU en un proceso diferencial está dado por la ecuación antes escrita.
La primera ley de la termodinámica se aplica a todo proceso de la naturaleza que parte de un estado de equilibrio y termina en otro. Un sistema esta en estado de equilibrio cuando podemos describirlo por medio de un grupo apropiado de parámetros constantes del sistema como presión ,el volumen, temperatura, campo magnético y otros. La primera ley sigue verificándose si los estados por los que pasa el sistema de un estado inicial (equilibrio), a su estado final (equilibrio), no son ellos mismos estados de equilibrio. Por ejemplo podemos aplicar la ley de la termodinámica a la explosión de un cohete en un tambor de acero cerrado.
La primera ley establece que la energía se conserva, sin embargo, cuando un cuerpo caliente y otro frío se ponen en contacto no ocurre que el primero se pone más caliente y el segundo más frío. Si bien no estamos violando la primera ley, esta no restringe nuestra capacidad de convertir trabajo en calor o calor en trabajo, especifica únicamente que la energía debe conservarse durante el proceso. La realidad es que, aunque podamos convertir una pequeña cantidad de trabajo en calor, no se ha podido hallar un procedimiento que convierta por completo una cantidad dada de calor en trabajo. La segunda ley de la termodinámica se ocupa de este problema y aunque su contenido pueda parecer esotérico o abstracto, su aplicación ha demostrado ser extremadamente práctico.
Procesos reversible e irreversibles: Consideremos un sistema típico en equilibrio termodinámico: una masa m de gas real encerrado en un dispositivo cilíndrico (cuyas paredes laterales son aislantes térmicos mientras que el piso es conductor) y un émbolo que mantiene un volumen V, dentro del cual el gas se encuentra a una presión p y una temperatura T, los que se mantienen constantes con el tiempo. En la base del cilindro tenemos una fuente de calor para mantener la temperatura.
Podemos variar de muchas maneras a otro estado de equilibrio en el cual la temperatura T sea la misma pero su volumen se reduzca a la mitad. Analicemos dos casos extremos.
I. Hacemos bajar el émbolo muy rápidamente y se espera que se establezca el equilibrio. Durante el proceso el gas es turbulento y su presión y temperatura no están bien definidas. Los estados intermedios en el cual se desarrolla el proceso no son de equilibrio. El proceso se denomina irreversible.
II. Si hacemos bajar el émbolo muy lentamente (despreciando a la fricción), la temperatura varía muy poco mientras que las otras variables termodinámicas estarán bien definidas a medida que vayan cambiando. Los cambios serán infinitesimales de manera que pueda invertirse la trayectoria mediante un cambio diferencial en su medio ambiente. Este proceso se denomina reversible.
Este caso no es solamente reversible sino también isotérmico ya que suponemos una variación infinitesimal (dT ).
También podríamos reducir el volumen adiabáticamente sacando al cilindro de la fuente de calor. Este proceso también puede ser reversible o irreversible dependiendo de la manera en que movamos al émbolo. Pero ΔU y ΔT no serαn los mismos para los procesos adiabáticos reversibles que para los irreversibles.
4.10. Segunda Ley
Las primeras máquinas térmicas construidas, fueron dispositivos muy eficientes. Solo una pequeña fracción del calor absorbido de la fuente de la alta temperatura se podía convertir en trabajo útil. Aun al progresar los diseños de la ingeniería, una fracción apreciable del calor absorbido se sigue descargando en el escape de una máquina a baja temperatura, sin que pueda convertirse en energía mecánica. Sigue siendo una esperanza diseñar una maquina que pueda tomar calor de un depósito abundante, como el océano y convertirlo íntegramente en un trabajo útil. Entonces no seria necesario contar con una fuente de calor una temperatura más alta que el medio ambiente quemando combustibles. De la misma manera, podría esperarse, que se diseñara un refrigerador que simplemente transporte calor, desde un cuerpo frío a un cuerpo caliente, sin que tenga que gastarse trabajo exterior. Ninguna de estas aspiraciones ambiciosas violan la primera ley de la termodinámica. La máquina térmica sólo podría convertir energía calorífica completamente en energía mecánica, conservándose la energía total del proceso. En el refrigerador simplemente se transmitiría la energía calorífica de un cuerpo frío a un cuerpo caliente, sin que se perdiera la energía en el proceso. Nunca se ha logrado ninguna de estas aspiraciones y hay razones para que se crea que nunca se alcanzarán.
La segunda ley de la termodinámica, que es una generalización de la experiencia, es una exposición cuyos artificios de aplicación no existen. Se tienen muchos enunciados de la segunda ley, cada uno de los cuales hace destacar un aspecto de ella, pero se puede demostrar que son equivalentes entre sí. Clausius la enuncio como sigue: No es posible para una máquina cíclica llevar continuamente calor de un cuerpo a otro que esté a temperatura más alta, sin que al mismo tiempo se produzca otro efecto (de compensación). Este enunciado desecha la posibilidad de nuestro ambicioso refrigerador, ya que éste implica que para transmitir calor continuamente de un objeto frío a un objeto caliente, es necesario proporcionar trabajo de un agente exterior. Por nuestra experiencia sabemos que cuando dos cuerpos se encuentran en contacto fluye calor del cuerpo caliente al cuerpo frío. En este caso, la segunda ley elimina la posibilidad de que la energía fluya del cuerpo frío al cuerpo caliente y así determina la dirección de la transmisión del calor. La dirección se puede invertir solamente por medio de gasto de un trabajo.
Kelvin (con Planck) enuncio la segunda ley con palabras equivalentes a las siguientes: es completamente imposible realizar una transformación cuyo único resultado final sea el de cambiar en trabajo el calor extraído de una fuente que se encuentre a la misma temperatura. Este enunciado elimina nuestras ambiciones de la máquina térmica, ya que implica que no podemos producir trabajo mecánico sacando calor de un solo depósito, sin devolver ninguna cantidad de calor a un depósito que esté a una temperatura más baja.
Para demostrar que los dos enunciados son equivalentes, necesitamos demostrar que si cualquiera de los enunciados es falso, el otro también debe serlo. Supóngase que es falso el enunciado de Clausius, de tal manera que se pudieran tener un refrigerador que opere sin que se consuma el trabajo. Podemos usar una máquina ordinaria para extraer calor de un cuerpo caliente, con el objeto de hacer trabajo y devolver parte del calor a un cuerpo frío.
Pero conectando nuestro refrigerador "perfecto" al sistema, este calor se regresaría al cuerpo caliente, sin gasto de trabajo, quedando así utilizable de nuevo para su uso en una máquina térmica. De aquí que la combinación de una maquina ordinaria y el refrigerador "perfecto" formará una máquina térmica que infringe el enunciado de Kelvin-Planck. O podemos invertir el argumento. Si el enunciado Kelvin-Planck fuera incorrecto, podríamos tener una máquina térmica que sencillamente tome calor de una fuente y lo convierta por completo en trabajo. Conectando esta máquina térmica "perfecta" a un refrigerador ordinario, podemos extraer calor de un cuerpo ordinario, podemos extraer calor de un cuerpo caliente, convertirlo completamente en trabajo, usar este trabajo para mover un refrigerador ordinario, extraer calor de un cuerpo frío, y entregarlo con el trabajo convertido en calor por el refrigerador, al cuerpo caliente. El resultado neto es una transmisión de calor desde un cuerpo frío, a un cuerpo caliente, sin gastar trabajo, lo infringe el enunciado de Clausius.
La segunda ley nos dice que muchos procesos son irreversibles. Por ejemplo, el enunciado de Clausius específicamente elimina una inversión simple del proceso de transmisión de calor de un cuerpo caliente, a un cuerpo frío. Algunos procesos, no sólo no pueden regresarse por sí mismos, sino que tampoco ninguna combinación de procesos pueden anular el efecto de un proceso irreversible, sin provocar otro cambio correspondiente en otra parte.
4.11. Ciclos Termodinámicos
Todas las relaciones termodinámicas importantes empleadas en ingeniería se derivan del primer y segundo principios de la termodinámica. Resulta útil tratar los procesos termodinámicos basándose en ciclos: procesos que devuelven un sistema a su estado original después de una serie de fases, de manera que todas las variables termodinámicas relevantes vuelven a tomar sus valores originales. En un ciclo completo, la energía interna de un sistema no puede cambiar, puesto que sólo depende de dichas variables. Por tanto, el calor total neto transferido al sistema debe ser igual al trabajo total neto realizado por el sistema.
Un motor térmico de eficiencia perfecta realizaría un ciclo ideal en el que todo el calor se convertiría en trabajo mecánico. El científico francés del siglo XIX Sadi Carnot, que concibió un ciclo termodinámico que constituye el ciclo básico de todos los motores térmicos, demostró que no puede existir ese motor perfecto. Cualquier motor térmico pierde parte del calor suministrado. El segundo principio de la termodinámica impone un límite superior a la eficiencia de un motor, límite que siempre es menor del 100%. La eficiencia límite se alcanza en lo que se conoce como ciclo de Carnot.
Ciclo de Carnot: Es un ciclo reversible que se representa en un diagrama p – v (presión en función del volumen) que si bien tiene sus limites en la capacidad que posee un sistema en convertir calor en trabajo, es utilizado en máquinas que usan vapor o una mezcla de combustible (con aire u oxígeno).
a – b: El gas está en un estado de equilibrio inicial representado por p1, V1, T1 dentro del cilindro anteriormente descrito. Dejamos que el gas se dilate lentamente hasta p2, V2, T1. durante el proceso el gas absorbe energía calórica Q1. La dilatación es isotérmica a T1 y el gas trabaja elevando al pistón y a su carga.
<>
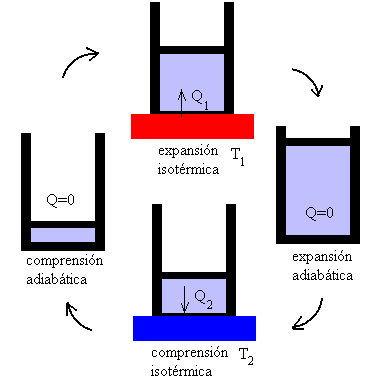
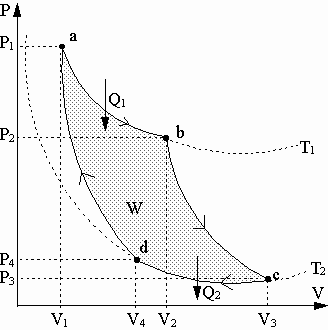
<>
Figura 17. Ciclo de Carnot
b – c: Ponemos el cilindro sobre una base no conductora y permitimos que el gas se dilate hasta p3, V3, T2. La dilatación es adiabática por que no entra ni sale calor del sistema. El gas efectúa un trabajo elevando el émbolo y su temperatura disminuye hasta T2.
c – d: Ponemos el cilindro sobre un deposito de calor (más frío) T2 y comprimimos el gas lentamente hasta p4, V4, T2. Durante ese proceso se transfiere una determinada cantidad de energía calórica Q2 del gas al depósito. La compresión es isotérmica a T2 y se efectúa trabajo sobre el gas a través del pistón y de su carga.
d – a: Ponemos al cilindro en un soporte no conductor y comprimimos lentamente hasta su posición inicial p1, V1, T1. La compresión es adiabática, se efectúa trabajo sobre el gas y su temperatura se eleva hasta T1.
El trabajo neto W efectuado por el sistema durante el ciclo está representado por el área encerrada en la trayectoria abcd. La cantidad de energía calórica neta recibida por el sistema se obtiene por la diferencia entre Q2 y Q1.
Como el estado inicial y final es el mismo, no hay cambio en la energía interna U del sistema. Por lo tanto, según la primera ley de termodinámica:
W = Q1 – Q2.
Eficiencia: es la relación entre el trabajo total efectuado por una máquina en un ciclo y el calor que, durante ese ciclo, se toma de la fuente de alta temperatura.
e = W /Q1 = (Q1-Q2)/Q1 = 1-Q2/Q1
Como dentro de un ciclo la cantidad de calor depende de la temperatura (la masa se mantiene constante) también podemos escribir:
e = 1 – (T2/T1) ecc.40
4.12. Entropía
La entropía, como todas las variables de estado, dependen sólo de los estados del sistema, y debemos estar preparados para calcular el cambio en la entropía de procesos irreversibles, conociendo sólo los estados de principio y al fin. Consideraremos dos ejemplos:
1.- Dilatación libre : Dupliquemos el volumen de un gas, haciendo que se dilate en un recipiente vacío, puesto que no se efectúa reacción alguna contra el vacío, W = 0 y, como el gas se encuentra encerrado entre paredes no conductoras, Q = 0. por la primera ley se entiende que
ΔU = 0 o: Ui = Uf
donde i y f se refieren a los estados inicial y final (de equilibrio). Si el gas es ideal, U depende únicamente de la temperatura y no de la presión o el volumen, y la ecuación Ui = Uf implica que Ti = Tf.
En realidad, la dilatación libre es irreversible, perdemos el control del medio ambiente una vez que abrimos la llave. Hay sin envergo, una diferencia de entropía si – sf, entre los estados de equilibrio inicial y final, pero no podemos calcularla con la ecuación
![]() ecc.41
ecc.41
, por que esta relación se aplica únicamente a trayectorias reversibles; si tratamos de usar la ecuación, tendremos inmediatamente la facultad de que Q = 0 para la dilatación libre - además - no sabremos como dar valores significativos de T en los estados intermedios que no son de equilibrio.
Entonces, ¿Cómo calcularemos Sf - Si para estos estados?, lo haremos determinando una trayectoria reversible (cualquier trayectoria reversible) que conecte los estados i y f, para así calcular el cambio de entropía de la trayectoria. En la dilatación libre, un trayecto reversible conveniente (suponiendo que se trate de un gas ideal) es una dilatación isotérmica de VI a Vf (=2Vi). Esto corresponde a la dilatación isotérmica que se lleva a cabo entre los puntos a y b del ciclo del Carnot.
Esto representa un grupo de operaciones muy diferentes de la dilatación libre y tienen en común la única condición de que conectan el mismo grupo de estados de equilibrio, i y f. De la ecuación 41 y el ejemplo 1 tenemos.
![]()
Esto es positivo, de tal manera que la entropía del sistema aumenta en este proceso adiabático irreversible. Nótese que la dilatación libre es un proceso que, en la naturaleza se desarrolla por sí mismo una vez iniciado. Realmente no podemos concebir lo opuesto, una compresión libre en la que el gas que en un recipiente aislado se comprima en forma espontánea de tal manera que ocupe solo la mitad del volumen que tiene disponible libremente. Toda nuestra experiencia nos dice que el primer proceso es inevitable y virtualmente, no se puede concebir el segundo.
2.- Transmisión irreversible de calor. Como otro ejemplo, considérense dos cuerpos que son semejantes en todo, excepto que uno se encuentra a una temperatura TH y el otro a la temperatura TC, donde TH> TC. Si ponemos ambos objetos en contacto dentro de una caja con paredes no conductoras, eventualmente llegan a la temperatura común Tm, con un valor entre TH y TC; como la dilatación libre, el proceso es irreversible, por que perdemos el control del medio ambiente, una vez que colocamos los dos cuerpos en la caja. Como la dilatación libre, este proceso también es adiabático (irreversible), por que no entra o sale calor en el sistema durante el proceso.
Para calcular el cambio de entropía para el sistema durante este proceso, de nuevo debemos encontrar un proceso reversible que conecte los mismos estados inicial y final y calcular el cambio de entropía, aplicando la ecuación 41 al proceso. Podemos hacerlo, si imaginamos que tenemos a nuestra disposición un deposito de calor de gran capacidad calorífica, cuya temperatura T este bajo nuestro control, digamos, haciendo girar una perilla. Primero ajustamos, la temperatura del deposito a TH a Tm, quitando calor al cuerpo caliente al mismo tiempo. En este proceso el cuerpo caliente pierde entropía, siendo el cambio de esta magnitud.
ΔSH = - (Q/T1)
Aquí T1 es una temperatura adecuada escogida entre TH y Tm y Q es el calor extraído.
En seguida ajustamos la temperatura de nuestro depósito a Tc y lo colocamos en contacto con el segundo cuerpo (el más frío). A continuación elevamos lentamente (reversiblemente) la temperatura del depósito de Tc a Tm, cediendo calor al cuerpo frío mientras lo hacemos. El cuerpo frío gana entropía en este proceso, siendo su cambio
ΔSC = + (Q/T2)
Aquí T2 es una temperatura adecuada, escogida para que quede entre Tc y Tm y Q es el calor agregado. El calor Q agregado al cuerpo frío es igual al Q extraído del cuerpo caliente.
Los dos cuerpos se encuentran ahora en la misma temperatura Tm y el sistema se encuentra en el estado de equilibrio final. El cambio de entropía para el sistema completo es:
![]() ecc.42
ecc.42
Como T1>T2, tenemos Sf >Si. De nuevo, como para la dilatación libre, la entropía del sistema aumenta en este proceso reversible y adiabático.
Nótese que, como la dilatación libre, nuestro ejemplo de la conducción del calor es un proceso que en la naturaleza se desarrolla por sí mismo una vez que se ha iniciado. En realidad no podemos concebir el proceso opuesto, en el cual, por ejemplo, una varilla de metal en equilibrio térmico a la temperatura del cuarto espontáneamente se ajuste de tal manera, que un extremo quede más caliente y en el otro más frío. De nuevo, la naturaleza tiene la preferencia irresistible para que el proceso se efectúe en una dirección determinada y no en la opuesta.
En cada uno de estos ejemplos, debemos distinguir cuidadosamente el proceso real (irreversible) (dilatación libre o transmisión del calor) y el proceso reversible que se introdujo, para que se pudiera calcular el cambio de entropía en el proceso real.
Podemos escoger cualquier proceso reversible, mientras conecte los mismos estados inicial y final que el proceso real; todos estos procesos reversibles llevarán al mismo cambio de entropía porque ella depende sólo los estados inicial y final y no de los procesos que los conectan, tanto si son reversibles como si son irreversibles.
0 comentarios