LA TEMPERATURA
La temperatura es una magnitud referida a las nociones comunes de caliente o frío. Por lo general, un objeto más "caliente" tendrá una temperatura mayor, y si fuere frío tendrá una temperatura menor. Físicamente es una magnitud escalar relacionada con la energía interna de un sistema termodinámico, definida por el principio cero de la termodinámica. Más específicamente, está relacionada directamente con la parte de la energía interna conocida como "energía sensible", que es la energía asociada a los movimientos de las partículas del sistema, sea en un sentido traslacional, rotacional, o en forma de vibraciones. A medida que es mayor la energía sensible de un sistema, se observa que está más "caliente"; es decir, que su temperatura es mayor. En el caso de un sólido, los movimientos en cuestión resultan ser las vibraciones de las partículas en sus sitios dentro del sólido. En el caso de un gas ideal monoatómico se trata de los movimientos traslacionales de sus partículas (para los gases multiatómicos los movimientos rotacional y vibracional deben tomarse en cuenta también). Dicho lo anterior, se puede definir la temperatura como la cuantificación de la actividad molecular de la materia.
La temperatura se mide con termómetros, los cuales pueden ser calibrados de acuerdo a una multitud de escalas que dan lugar a unidades de medición de la temperatura. En el Sistema Internacional de Unidades, la unidad de temperatura es el kelvin (K), y la escala correspondiente es la escala Kelvin o escala absoluta, que asocia el valor "cero kelvin" (0 K) al "cero absoluto", y se gradúa con un tamaño de grado igual al del grado Celsius. Sin embargo, fuera del ámbito científico el uso de otras escalas de temperatura es común. La escala más extendida es la escala Celsius (antes llamada centígrada); y, en mucha menor medida, y prácticamente sólo en los Estados Unidos, la escala Fahrenheit. También se usa a veces la escala Rankine (°R) que establece su punto de referencia en el mismo punto de la escala Kelvin, el cero absoluto, pero con un tamaño de grado igual al de la Fahrenheit, y es usada únicamente en Estados Unidos, y sólo en algunos campos de la ingeniería
Para dar la definición de temperatura con base en la segunda ley, habrá que introducir el concepto de máquina térmica la cual es cualquier dispositivo capaz de transformar calor en trabajo mecánico. En particular interesa conocer el planteamiento teórico de la máquina de Carnot, que es una máquina térmica de construcción teórica, que establece los límites teóricos para la eficiencia de cualquier máquina térmica real.

En una máquina térmica cualquiera, el trabajo que esta realiza corresponde a la diferencia entre el calor que se le suministra y el calor que sale de ella. Por lo tanto, la eficiencia es el trabajo que realiza la máquina dividido entre el calor que se le suministra:
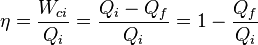 (1)
(1)Donde Wci es el trabajo hecho por la máquina en cada ciclo. Se ve que la eficiencia depende sólo de Qi y de Qf. Ya que Qi y Qf corresponden al calor transferido a las temperaturas Ti y Tf, es razonable asumir que ambas son funciones de la temperatura:
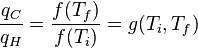 (2)
(2)Sin embargo, es posible utilizar a conveniencia, una escala de temperatura tal que
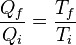 (3)
(3)Sustituyendo la ecuación (3) en la (1) relaciona la eficiencia de la máquina con la temperatura:
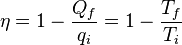 (4)
(4)Hay que notar que para Tf = 0 K la eficiencia se hace del 100%, temperaturas inferiores producen una eficiencia aún mayor que 100%. Ya que la primera ley de la termodinámica prohíbe que la eficiencia sea mayor que el 100%, esto implica que la mínima temperatura que se puede obtener en un sistema microscópico es de 0 K. Reordenando la ecuación (4) se obtiene:
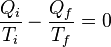 (5)
(5)Aquí el signo negativo indica la salida de calor del sistema. Esta relación sugiere la existencia de una función de estado S definida por:
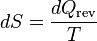 (6)
(6)Donde el subíndice indica un proceso reversible. El cambio de esta función de estado en cualquier ciclo es cero, tal como es necesario para cualquier función de estado. Esta función corresponde a la entropía del sistema, que fue descrita anteriormente. Reordenando la ecuación siguiente para obtener una definición de temperatura en términos de la entropía y el calor:
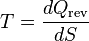 (7)
(7)Para un sistema en que la entropía sea una función de su energía interna E, su temperatura esta dada por:
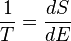 (8)
(8)Esto es, el recíproco de la temperatura del sistema es la razón de cambio de su entropía con respecto a su energía.
to, pero con un tamaño de grado igual al de la Fahrenheit, y es usada únicamente en Estados Unidos, y sólo en algunos campos de la ingeniería
2 comentarios
ismael lopez -
CESAR RODRIGUEZ JABIL A -